Micardis 80 Mg Yan Etkileri
Micardis 80 mg 28 tablet
Boehringer Ingelheim » MICARDIS 80 MG 28 TABLET
Güncelleme: 15 Ekim 2018
|

4. Olası yan etkiler nelerdir?
Tüm ilaçlar gibi, MICARDIS'in içeriğinde bulunan maddelere duyarlı olan kişilerde yan etkiler olabilir.
Aşağıdakilerden biri olursa MICARDIS kullanmayı durdurunuz ve DERHAL doktorunuza bildiriniz veya size en yakın hastanenin acil bölümüne başvurunuz:
Sepsis*: ("kan zehirlenmesi" olarak da adlandırılan, bütün vücutta enflamasyon (iltihap) şeklinde ortaya çıkan şiddetli bir enfeksiyon durumu), cilt ve mukozada ani şişme (anjiyoödem).
Bunların hepsi çok ciddi yan etkilerdir ve oldukça seyrek (1000 kullanıcıdan 1'ine kadar sıklıkta) görülür. Bu durumda ilacı kullanmayı derhal kesiniz ve derhal doktorunuza başvurunuz. Bu etkiler tedavi edilmez ise ölümle sonuçlanabilir.
MICARDIS'in olası yan etkileri:
Yaygın yan etkiler (10 kullanıcıdan 1 kişiye kadarını etkiler):
Kan basıncında düşme (kardiyovasküler olay azaltma için kullanan kastalarda)
Yaygın olmayan yan etkiler (100 kullanıcıdan 1kişiye kadarını etkiler):
İdrar yolu enfeksiyonları, üst solunum yolu enfeksiyonları (örneğin: boğaz ağrısı, sinüslerde iltihap, soğuk algınlığı), alyuvarlarda azalma (anemi), potasyum düzeyinde yükselme, uykuya dalmada güçlük, depresyon, bayılma, baş dönmesi, kalp atımının yavaşlaması, düşük tansiyon, ayağa kalkarken baş dönmesi (ortostatik hipotansiyon), nefes darlığı, öksürük, karın ağrısı, ishal, karın bölgesinde rahatsızlık hissi, şişkinlik, kusma, kaşıntı, terlemede artma, ilaç döküntüsü, sırt ağrısı, kasta kramplar, kas ağrısı, akut böbrek yetmezliği dahil böbrek işlevlerinde bozulma, göğüste ağrı, halsizlik hissi ve kanda kreatinin (vücutta üretilen bir maddeden oluşan ve böbrek işlevlerini değerlendirmek için laboratuar testlerinde aranan bir madde) düzeyinde artma.
Seyrek yan etkiler (1000 kullanıcıdan 1 kişiye kadarını etkiler):
Çok seyrek yan etkiler (10.000 kullanıcıdan 1 kişiye kadarını etkiler):
Akciğer dokusunda ilerleyen nedbeleşme (bağ dokusu oluşumu) (interstisyel akciğer hastalığı)**
*Bu olay şans eseri olarak ortaya çıkmış olabilir veya henüz bilinmeyen bir mekanizmaya bağlı olarak görülebilir.
** Telmisartan kullanımı sırasında akciğer dokusunda ilerleyen nedbeleşme (bağ dokusu oluşumu) vakaları bildirilmiştir. Bununla birlikte, nedenin telmisartan olup olmadığı bilinmemektedir.
Herhangi bir yan etki ile karşılaşırsanız, doktorunuza veya eczacınıza bildiriniz.
Eğer bu kullanma talimatında bahsi geçmeyen herhangi bir yan etki ile karşılaşırsanız, doktorunuzu veya eczacınızı bilgilendiriniz
Nedir Ne için Kullanılır?
Kullanmadan Önce Dikkat Edilmesi Gerekenler
Nasıl Kullanılır?
4. Olası yan etkiler nelerdir?
Tüm ilaçlar gibi, MICARDIS'in içeriğinde bulunan maddelere duyarlı olan kişilerde yan etkiler olabilir.
Aşağıdakilerden biri olursa MICARDIS kullanmayı durdurunuz ve DERHAL doktorunuza bildiriniz veya size en yakın hastanenin acil bölümüne başvurunuz:
Sepsis*: ("kan zehirlenmesi" olarak da adlandırılan, bütün vücutta enflamasyon (iltihap) şeklinde ortaya çıkan şiddetli bir enfeksiyon durumu), cilt ve mukozada ani şişme (anjiyoödem).
Bunların hepsi çok ciddi yan etkilerdir ve oldukça seyrek (1000 kullanıcıdan 1'ine kadar sıklıkta) görülür. Bu durumda ilacı kullanmayı derhal kesiniz ve derhal doktorunuza başvurunuz. Bu etkiler tedavi edilmez ise ölümle sonuçlanabilir.
MICARDIS'in olası yan etkileri:
Yaygın yan etkiler (10 kullanıcıdan 1 kişiye kadarını etkiler):
Kan basıncında düşme (kardiyovasküler olay azaltma için kullanan kastalarda)
Yaygın olmayan yan etkiler (100 kullanıcıdan 1kişiye kadarını etkiler):
İdrar yolu enfeksiyonları, üst solunum yolu enfeksiyonları (örneğin: boğaz ağrısı, sinüslerde iltihap, soğuk algınlığı), alyuvarlarda azalma (anemi), potasyum düzeyinde yükselme, uykuya dalmada güçlük, depresyon, bayılma, baş dönmesi, kalp atımının yavaşlaması, düşük tansiyon, ayağa kalkarken baş dönmesi (ortostatik hipotansiyon), nefes darlığı, öksürük, karın ağrısı, ishal, karın bölgesinde rahatsızlık hissi, şişkinlik, kusma, kaşıntı, terlemede artma, ilaç döküntüsü, sırt ağrısı, kasta kramplar, kas ağrısı, akut böbrek yetmezliği dahil böbrek işlevlerinde bozulma, göğüste ağrı, halsizlik hissi ve kanda kreatinin (vücutta üretilen bir maddeden oluşan ve böbrek işlevlerini değerlendirmek için laboratuar testlerinde aranan bir madde) düzeyinde artma.
Seyrek yan etkiler (1000 kullanıcıdan 1 kişiye kadarını etkiler):
Çok seyrek yan etkiler (10.000 kullanıcıdan 1 kişiye kadarını etkiler):
Akciğer dokusunda ilerleyen nedbeleşme (bağ dokusu oluşumu) (interstisyel akciğer hastalığı)**
*Bu olay şans eseri olarak ortaya çıkmış olabilir veya henüz bilinmeyen bir mekanizmaya bağlı olarak görülebilir.
** Telmisartan kullanımı sırasında akciğer dokusunda ilerleyen nedbeleşme (bağ dokusu oluşumu) vakaları bildirilmiştir. Bununla birlikte, nedenin telmisartan olup olmadığı bilinmemektedir.
Herhangi bir yan etki ile karşılaşırsanız, doktorunuza veya eczacınıza bildiriniz.
Eğer bu kullanma talimatında bahsi geçmeyen herhangi bir yan etki ile karşılaşırsanız, doktorunuzu veya eczacınızı bilgilendiriniz
Saklanması
Eşdeğerleri
Etkin Madde
Doküman (PDF)
 | Önemli Uyarı! Sitemiz doktorunuzun veya eczacınızın yerini almayı hedeflememektedir. Bilgilerin yanlış anlaşılmasından ve buna bağlı olarak doğabilecek sorunlardan sitemiz yasal sorumluluk altında değildir. Gerçek bir tanı ve tedavi için hasta ve doktorun yüzyüze gelmesi gereklidir. Bu sitede verilen bilgilerin kullanılmasının sorumlulugu tümüyle kullanıcıya aittir. İlaç Arşivi © 2018 Tüm hakları saklıdır. |
- Genel isim:telmisartan
- Marka adı:Micardis
Micardis nedir ve nasıl kullanılır?
Micardis, yüksek tansiyon (hipertansiyon) semptomlarını tedavi etmek ve riskini azaltmak için kullanılan reçeteli bir ilaçtır. kalp-damar hastalığı inme gibi ve kalp krizi . Micardis tek başına veya diğer ilaçlarla birlikte kullanılabilir.
Micardis, ARB adı verilen bir ilaç sınıfına aittir.
Micardis'in 18 yaşından küçük çocuklarda güvenli ve etkili olup olmadığı bilinmemektedir.
Micardis'in olası yan etkileri nelerdir?
Micardis, aşağıdakiler dahil ciddi yan etkilere neden olabilir:
- baş dönmesi ,
- şişme,
- hızlı kilo alımı,
- mide bulantısı,
- zayıflık,
- çınlayan duygu,
- göğüs ağrısı,
- düzensiz kalp atışları ve
- hareket kaybı
Yukarıda listelenen belirtilerden herhangi birine sahipseniz hemen tıbbi yardım alın.
Micardis'in en yaygın yan etkileri şunlardır:
Sizi rahatsız eden veya geçmeyen herhangi bir yan etkiniz varsa doktorunuza söyleyin.
Bunlar Micardis'in tüm olası yan etkileri değildir. Daha fazla bilgi için, lütfen doktorunuza veya eczacınıza danışınız.
Yan etkiler hakkında tıbbi tavsiye almak için doktorunuzu arayın. Yan etkileri 1-800-FDA-1088'de FDA'ya bildirebilirsiniz.
UYARI
FETAL TOKSİSİTE
AÇIKLAMA
MICARDIS, anon-peptid anjiyotensin II reseptörüdür (tip ATbir) antagonist.
Telmisartan kimyasal olarak 4 '- [(1,4'-dimetil-2'-propil [2,6'-bi-1H-benzimidazol] -1'-il) metil] - [1,1'-bifenil] olarak tanımlanmaktadır -2-karboksilik asit. Ampirik formülü C33H30N4VEYAikimoleküler ağırlığı 514.63'tür ve yapısal formülü:
 |
Telmisartan, beyaz ila hafif sarımsı bir katıdır. Suda ve 3 ila 9 pH aralığında pratik olarak çözünmez, kuvvetli asitte idareli çözünür (hidroklorik asitte çözünmeyenler hariç) ve güçlü bazda çözünür.
MICARDIS, 20 mg, 40 mg veya 80 mg telmisartan içeren oral uygulama için tabletler halinde mevcuttur. Tabletler aşağıdaki aktif olmayan bileşenleri içerir: sodyum hidroksit, meglumin, povidon, sorbitol ve magnezyum stearat. MICARDIS tabletleri higroskopiktir ve nemden korunmayı gerektirir.
BelirteçlerBELİRTEÇLER
MICARDIS HCT (telmisartan ve hidroklorotiyazid), kan basıncını düşürmek için hipertansiyon tedavisinde endikedir. Kan basıncını düşürmek, ölümcül ve ölümcül olmayan kardiyovasküler olayların, özellikle felç ve miyokard enfarktüslerinin riskini azaltır. Bu faydalar, bu ilacın esas olarak ait olduğu sınıflar dahil olmak üzere çok çeşitli farmakolojik sınıflardan antihipertansif ilaçların kontrollü çalışmalarında görülmüştür. MICARDIS HCT ile riskin azaldığını gösteren kontrollü çalışma yoktur.
Yüksek tansiyonun kontrolü, uygun şekilde lipid kontrolü, diyabet yönetimi, antitrombotik tedavi, sigarayı bırakma, egzersiz ve sınırlı sodyum alımı dahil olmak üzere kapsamlı kardiyovasküler risk yönetiminin bir parçası olmalıdır. Birçok hasta, kan basıncı hedeflerine ulaşmak için birden fazla ilaca ihtiyaç duyacaktır. Hedefler ve yönetimle ilgili özel tavsiyeler için, Ulusal Yüksek Kan Basıncı Eğitim Programı'nın Yüksek Kan Basıncının Önlenmesi, Tespiti, Değerlendirilmesi ve Tedavisi Ortak Ulusal Komitesi (JNC) gibi yayınlanmış yönergelere bakın.
Çeşitli farmakolojik sınıflardan ve farklı etki mekanizmalarına sahip çok sayıda antihipertansif ilaç, kardiyovasküler morbidite ve mortaliteyi azaltmak için randomize kontrollü çalışmalarda gösterilmiştir ve bunun kan basıncını düşürdüğü ve diğer bazı farmakolojik özellikleri olmadığı sonucuna varılabilir. bu faydalardan büyük ölçüde sorumlu olan ilaçlar. En büyük ve en tutarlı kardiyovasküler sonuç yararı, inme riskinde bir azalma olmuştur, ancak miyokard enfarktüsünde ve kardiyovasküler mortalitede azalma da düzenli olarak görülmüştür.
Yüksek sistolik veya diyastolik basınç, kardiyovasküler riskte artışa neden olur ve mmHg başına mutlak risk artışı, daha yüksek kan basınçlarında daha fazladır, bu nedenle şiddetli hipertansiyondaki en küçük düşüşler bile önemli fayda sağlayabilir. Kan basıncının düşürülmesinden kaynaklanan göreceli risk azalması, değişken mutlak riske sahip popülasyonlar arasında benzerdir, bu nedenle, yüksek risk altında olan hastalarda (örneğin, diyabetli veya hiperlipidemili hastalar) mutlak fayda daha yüksektir ve bu tür hastalar beklenecektir. Daha agresif tedaviden daha düşük tansiyon hedefine fayda sağlamak.
Bazı antihipertansif ilaçların siyah hastalarda daha küçük kan basıncı etkileri (monoterapi olarak) ve birçok antihipertansif ilacın ek onaylanmış endikasyonları ve etkileri vardır (örneğin anjin, kalp yetmezliği veya diyabetik böbrek hastalığı). Bu hususlar tedavi seçimine rehberlik edebilir [bkz. Klinik çalışmalar ].
MICARDIS HCT, hipertansiyon tedavisi için başlangıç tedavisi için endike değildir [bkz. DOZAJ VE YÖNETİM ].
MICARDIS HCT tek başına veya diğer antihipertansif ajanlarla kombinasyon halinde kullanılabilir.
DozajDOZAJ VE YÖNETİM
Dozaj Bilgileri
MICARDIS HCT'de 80 mg, günde bir kez 80 mg / 12.5 mg telmisartan monoterapisi ile kan basıncı yeterince kontrol edilmeyen bir hastayı başlatın. Doz, gerekirse 2 ila 4 hafta sonra 160 mg / 25 mg'a kadar titre edilebilir.
Kan basıncı günde bir kez 25 mg hidroklorotiyazid ile yeterince kontrol edilmeyen veya kontrol edilen, ancak günde bir kez MICARDIS HCT 80 mg / 12.5 mg ile bu rejimle hipokalemi yaşayan bir hastayı başlatın. Doz, gerekirse 2 ila 4 hafta sonra 160 mg / 25 mg'a kadar titre edilebilir.
Ayrı bileşenlere (telmisartan ve hidroklorotiyazid) göre titre edilen hastalar bunun yerine karşılık gelen MICARDIS HCT dozunu alabilir.
MICARDIS HCT, diğer antihipertansif ilaçlarla birlikte uygulanabilir.
Karaciğer Yetmezliği İçin Doz Ayarlaması
40 mg / 12,5 mg kombinasyonunu kullanarak yakın tıbbi gözetim altında safra tıkanıklığı bozuklukları veya karaciğer yetmezliği olan hastaları başlatın. MICARDIS HCT tabletleri şiddetli karaciğer yetmezliği olan hastalar için önerilmez [bkz. Belirli Popülasyonlarda Kullanım ve KLİNİK FARMAKOLOJİ ].
Önemli Uygulama Talimatları
MICARDIS HCT tabletleri, uygulamadan hemen öncesine kadar blisterlerden çıkarılmamalıdır.
NASIL TEDARİK EDİLDİ
Dozaj Formları ve Güçlü Yönleri
- Boehringer Ingelheim logosu ve H4 ile işaretlenmiş 40 mg / 12,5 mg, kırmızı ve beyaz tabletler
- 80 mg / 12,5 mg, Boehringer Ingelheim logosu ve H8 ile işaretlenmiş kırmızı ve beyaz tabletler
- Boehringer Ingelheim logosu ve H9 ile işaretlenmiş 80 mg / 25 mg, sarı ve beyaz tabletler
Saklama ve Taşıma
MICARDIS HCT, telmisartan ve hidroklorotiyazid içeren bikonveks iki katmanlı, dikdörtgen şekilli, kaplamasız tabletler olarak üç güçte mevcuttur:
- 40 mg / 12,5 mg tablet: Boehringer Ingelheim şirket sembolü ve H4 ile işaretlenmiş kırmızı ve beyaz (kırmızı benekler içerebilir); 30 tabletlik kartonlarda 3 x 10 kart ( NDC 0597-0043-37)
- 80 mg / 12,5 mg tablet: Boehringer Ingelheim şirket sembolü ve H8 ile işaretlenmiş kırmızı ve beyaz (kırmızı benekler içerebilir); 30 tabletlik kartonlarda 3 x 10 kart ( NDC 0597-0044-37)
- 80 mg / 25 mg tablet: Boehringer Ingelheim şirket sembolü ve H9 ile işaretlenmiş sarı ve beyaz (sarı benekler içerebilir); 30 tabletlik kartonlarda 3 x 10 kart ( NDC 0597-0042-37)
Depolama
25 ° C'de (77 ° F) saklayın; gezilere 15 ° C-30 ° C (59 ° F-86 ° F) izin verilir [USP Kontrollü Oda Sıcaklığına bakın]. Tabletler, uygulamadan hemen öncesine kadar kabarcıklardan çıkarılmamalıdır.
Distribütör: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 ABD. Revize: Ekim 2018
Yan etkilerYAN ETKİLER
Aşağıdaki advers reaksiyonlar etiketlemede başka bir yerde tartışılmıştır:
- Hipotansiyon [bkz. UYARILAR VE ÖNLEMLER ]
- Böbrek Yetmezliği [bkz. UYARILAR VE ÖNLEMLER ]
- Elektrolitler ve Metabolik Bozukluklar [bkz. UYARILAR VE ÖNLEMLER ]
Klinik Deney Deneyimi
Klinik çalışmalar çok çeşitli koşullar altında yürütüldüğünden, bir ilacın klinik çalışmalarında gözlenen advers reaksiyon oranları, başka bir ilacın klinik çalışmalarındaki oranlarla doğrudan karşılaştırılamaz ve pratikte gözlemlenen oranları yansıtmayabilir.
MICARDIS HCT, 6 aydan uzun süredir hipertansiyon tedavisi gören 716 ve 1 yıldan uzun süredir 420 hasta dahil olmak üzere 1700'den fazla hastada güvenlik açısından değerlendirilmiştir. Advers reaksiyonlar, daha önce telmisartan ve / veya hidroklorotiyazid ile bildirilenlerle sınırlandırılmıştır.
Telmisartan / hidroklorotiyazid ile tedavi edilen hastalarda & ge;% 2'lik bir insidansta ve plasebo ile tedavi edilen hastalara göre daha yüksek oranda meydana gelen advers reaksiyonlar Tablo 1'de sunulmuştur [bkz. Klinik çalışmalar ].
Tablo 1 Telmisartan / Hidroklorotiyazid İle Tedavi Edilen Hastalarda & ge;% 2 ve Plasebo ile Tedavi Edilen Hastalara Göre Daha Yüksek Bir Oranla Meydana Gelen Olumsuz Reaksiyonlar *
| Telmisartan / Hidroklorotiyazid (n = 414) | Plasebo (n = 74) | Telmisartan (n = 209) | Hidroklorotiyazid (n = 121) | |
| Bir bütün olarak vücut | ||||
| Yorgunluk | % 3 | bir% | % 3 | % 3 |
| Grip benzeri semptomlar | iki% | bir% | iki% | % 3 |
| Merkezi / Periferik sinir sistemi | ||||
| Baş dönmesi | % 5 | bir% | % 4 | % 6 |
| Mide bağırsak sistemi | ||||
| İshal | % 3 | % 0 | % 5 | iki% |
| Mide bulantısı | iki% | % 0 | bir% | iki% |
| Solunum sistemi bozukluğu | ||||
| Sinüzit | % 4 | % 3 | % 3 | % 6 |
| Üst solunum yolu enfeksiyonu | % 8 | % 7 | % 7 | % 10 |
| * tüm telmisartan (20 ila 160 mg), hidroklorotiyazid (6.25 ila 25 mg) dozlarını ve bunların kombinasyonlarını içerir | ||||
Telmisartan / hidroklorotiyazid için gözlemlenen diğer advers reaksiyonlar şunlardır: ağrı (sırt ve karın dahil), dispepsi, eritem, kusma, bronşit ve farenjit.
bakteri ne tür bir antibiyotiktir
Erkek ve kadınlarda, yaşlı ve genç hastalarda ve siyahi ve siyah olmayan hastalarda yaklaşık olarak aynı oranlarda advers reaksiyonlar meydana geldi.
Telmisartan
Telmisartan ile bildirilen diğer yan etkiler aşağıda listelenmiştir:
Otonom sinir sistemi: iktidarsızlık, artan terleme, kızarma
Bir Bütün Olarak Vücut: alerji, ateş, bacak ağrısı, göğüs ağrısı
Kardiyovasküler: çarpıntı, anjina pektoris, anormal EKG, hipertansiyon, periferik ödem
Merkezi sinir sistemi: uykusuzluk, uyku hali, migren, parestezi, istemsiz kas kasılmaları, hipoestezi
Gastrointestinal: şişkinlik, kabızlık, gastrit, ağız kuruluğu, hemoroid, gastroözofageal reflü, diş ağrısı
Hepato-biliyer: karaciğer enzimlerinin veya serum bilirubinin yükselmesi
Metabolik: gut, hiperkolesterolemi, diabetes mellitus
Kas-iskelet sistemi: artrit, artralji, bacak krampları, miyalji
Psikiyatrik: anksiyete, depresyon, sinirlilik
Direnç Mekanizması: enfeksiyon, apse, orta kulak iltihabı
Solunum: astım, rinit, nefes darlığı, burun kanaması
Cilt: dermatit, egzama, kaşıntı
İdrar: işeme sıklığı, sistit
Vasküler: serebrovasküler bozukluk
Özel Duyular: anormal görme, konjunktivit, kulak çınlaması, kulak ağrısı
Hidroklorotiyazid
Hidroklorotiyazid ile bildirilen diğer yan etkiler aşağıda listelenmiştir:
Bir Bütün Olarak Vücut: zayıflık
Sindirim: pankreatit, sarılık (intrahepatik kolestatik sarılık), sialadenit, kramp, mide tahrişi
Hematolojik: aplastik anemi, agranülositoz, lökopeni, hemolitik anemi, trombositopeni
Aşırı duyarlılık: purpura, fotosensitivite, ürtiker, nekrotizan anjiyit (vaskülit ve kutanöz vaskülit), ateş, pnömoni ve pulmoner ödem dahil solunum sıkıntısı, anafilaktik reaksiyonlar
Metabolik: hiperglisemi, glikozüri
Kas-iskelet sistemi: kas spazmı
Sinir Sistemi / Psikiyatrik: huzursuzluk
Böbrek: interstisyel nefrit
Cilt: Stevens-Johnson sendromu dahil eritema multiforme, toksik epidermal nekroliz dahil eksfolyatif dermatit
Özel Duyular: geçici bulanık görme, ksantopsi
Klinik Laboratuvar Bulguları
Kreatinin, Kan Üre Azotu (BUN)
Kontrollü çalışmalarda MICARDIS HCT tabletleri ile tedavi edilen esansiyel hipertansiyonlu hastaların sırasıyla% 2.8 ve% 1.4'ünde BUN (& ge; 11,2 mg / dL) ve serum kreatinininde (& ge; 0,5 mg / dL) artışlar gözlenmiştir. BUN veya kreatinin artışı nedeniyle hiçbir hasta MICARDIS HCT tabletleriyle tedaviyi bırakmadı [bkz. UYARILAR VE ÖNLEMLER ].
Pazarlama Sonrası Deneyim
MICARDIS HCT'nin onay sonrası kullanımı sırasında aşağıdaki advers reaksiyonlar tespit edilmiştir. Bu reaksiyonlar, belirsiz büyüklükteki bir popülasyondan gönüllü olarak bildirildiğinden, sıklıklarını güvenilir bir şekilde tahmin etmek veya ilaca maruz kalma ile nedensel bir ilişki kurmak her zaman mümkün değildir.
Kan ve Lenfatik Sistem Bozuklukları: eozinofili
Kardiyak Bozukluklar: atriyal fibrilasyon, konjestif kalp yetmezliği, miyokard enfarktüsü, taşikardi, bradikardi
Kulak ve Labirent Bozuklukları: baş dönmesi
Genel Bozukluklar ve Uygulama Yeri Koşulları: asteni, ödem
Hepato-biliyer: Anormal karaciğer fonksiyonu / karaciğer bozukluğu
Bağışıklık Sistemi Bozuklukları: anafilaktik tepki
Enfeksiyonlar ve Enfestasyonlar: idrar yolu enfeksiyonu
Araştırmalar: artan CPK
Metabolizma ve Beslenme Bozuklukları: hipoglisemi (diyabetik hastalarda)
Kas İskelet ve Bağ Dokusu Bozuklukları: tendon ağrısı (tendinit, tenosinovit dahil), rabdomiyoliz
Sinir Sistemi Bozuklukları: senkop, baş ağrısı
Böbrek ve Üriner Hastalıklar: böbrek yetmezliği, akut böbrek yetmezliği dahil böbrek yetmezliği
Üreme Sistemi ve Meme Hastalıkları: erektil disfonksiyon
Solunum, Göğüs ve Mediastinal Bozukluklar: öksürme
Deri ve Deri Altı Doku Bozuklukları: ilaç döküntüsü (toksik deri döküntüsü çoğunlukla toksik deri döküntüsü, döküntü ve ürtiker olarak rapor edilir), anjiyoödem (ölümle sonuçlanan)
Vasküler Bozukluk: ortostatik hipotansiyon
İlaç etkileşimleriİLAÇ ETKİLEŞİMLERİ
Serum Potasyum Artırıcı Ajanlar
Telmisartanın serum potasyum düzeylerini yükselten diğer ilaçlarla birlikte uygulanması hiperkalemiye neden olabilir. Bu tür hastalarda serum potasyumunu izleyin.
Lityum
Telmisartan dahil tiazid diüretiklerin veya anjiyotensin II reseptör antagonistlerinin eşzamanlı kullanımı ile serum lityum konsantrasyonlarında ve lityum toksisitesinde artışlar bildirilmiştir. MICARDIS HCT ve lityum alan hastalarda lityum seviyelerini izleyin.
Seçici Siklooksijenas E-2 İnhibitörleri Dahil Steroid Olmayan Anti-Enflamatuar Ajanlar
Telmisartan
Seçici Siklooksijenaz-2 İnhibitörleri (COX-2 İnhibitörleri) dahil Steroidal Olmayan Anti-Enflamatuar Ajanlar: Yaşlı, hacmi tükenmiş (diüretik tedavide olanlar dahil) veya böbrek fonksiyonu bozulmuş hastalarda, NSAID'lerin birlikte uygulanması, telmisartan dahil ARB'ler ile seçici COX-2 inhibitörleri, olası akut böbrek yetmezliği dahil olmak üzere böbrek fonksiyonunun bozulmasına neden olabilir. Bu etkiler genellikle geri döndürülebilir. ARB'lerin antihipertansif etkisi NSAID'ler tarafından zayıflatılabilir. Bu nedenle, MICARDIS HCT ve NSAID alan hastalarda böbrek fonksiyonunu ve kan basıncını periyodik olarak izleyin.
Hidroklorotiyazid
Seçici bir COX2 inhibitörü dahil olmak üzere steroidal olmayan bir anti-enflamatuar ajanın uygulanması, diüretiklerin diüretik, natriüretik ve antihipertansif etkilerini azaltabilir. Bu nedenle, MICARDIS HCT ve seçici COX2 inhibitörleri dahil steroidal olmayan anti-enflamatuar ajanlar birlikte kullanıldığında, diüretiğin istenen etkisinin elde edilip edilmediğini yakından gözlemleyin.
Aldosteron Sisteminde Renin-Anjiyotenlerin İkili Ablukası ve Böbrek Fonksiyonundaki Değişiklikler
Renin-anjiyotensin-aldosteron sisteminin (RAS) anjiyotensin blokerleri, ACE inhibitörleri veya aliskiren ile ikili blokajı, hipotansiyon, hiperkalemi ve böbrek yetmezliği risklerinde artış ile ilişkilidir. ONTARGET denemesi, aterosklerotik hastalığı olan veya son organ hasarı olan diyabeti olan 25.620 hastayı ve 55 yaşındaki hastaları dahil etti, onları yalnızca telmisartan (ARB), yalnızca ramipril (ACE inhibitörü) veya kombinasyona randomize etti ve bunları medyan 56 takip etti ay. ARB ve ACE inhibitörü kombinasyonunu alan hastalar, ARB monoterapisi veya ACE inhibitörü monoterapisine kıyasla herhangi bir ek fayda (kardiyovasküler ölüm, miyokard enfarktüsü, inme veya kalp yetmezliğinden hastaneye yatış riskinde ek azalma yok) elde etmemiş, ancak artmış bir monoterapi grupları ile karşılaştırıldığında böbrek fonksiyon bozukluğu (örneğin, akut böbrek yetmezliği) insidansı.
Genel olarak, RAS inhibitörlerinin birlikte kullanımından kaçının. MICARDIS HCT ve RAS'ı etkileyen diğer ajanlar kullanan hastalarda kan basıncını, böbrek fonksiyonunu ve elektrolitleri yakından izleyin.
Diyabetli hastalarda aliskiren'i MICARDIS HCT ile birlikte uygulamayın. Böbrek yetmezliği (GFR) olan hastalarda aliskiren ile MICARDIS HCT'nin eşzamanlı kullanımından kaçının.
Digoksin
Telmisartan digoksin ile birlikte uygulandığında, digoksin pik plazma konsantrasyonunda (% 49) ve çukur konsantrasyonunda (% 20) medyan artışlar gözlenmiştir. Eşzamanlı MICARDIS HCT ve digoksin alan hastalarda digoksin seviyelerini izleyin.
Antidiyabetik İlaçlar (Oral Ajanlar ve İnsülin)
Hidroklorotiyazid ile birlikte uygulandığında antidiyabetik ilaçların dozaj ayarlaması gerekebilir.
Kolestiramin ve Kolestipol Reçineleri
Hidroklorotiyazidin emilimi, anyonik değişim reçinelerinin varlığında bozulur. Hidroklorotiyazid ve reçinenin dozajı, hidroklorotiyazid reçineden en az 4 saat önce veya 4-6 saat sonra uygulanacak şekilde kademelendirilir.
Uyarılar ve ÖnlemlerUYARILAR
Bir parçası olarak dahil edilmiştir 'ÖNLEMLER' Bölüm
ÖNLEMLER
Fetal Toksisite
Telmisartan
Gebeliğin ikinci ve üçüncü trimesterinde renin-anjiyotensin sistemine etki eden ilaçların kullanımı fetal böbrek fonksiyonunu azaltır ve fetal ve neonatal morbidite ve ölümü artırır. Ortaya çıkan oligohidramnios, fetal akciğer hipoplazisi ve iskelet deformasyonları ile ilişkilendirilebilir. Potansiyel neonatal yan etkiler arasında kafatası hipoplazisi, anüri, hipotansiyon, böbrek yetmezliği ve ölüm bulunur. Gebelik tespit edildiğinde, MICARDIS HCT'yi mümkün olan en kısa sürede sonlandırın.
Hidroklorotiyazid
Tiyazidler plasenta bariyerini geçer ve kordon kanında görülür. Advers reaksiyonlar arasında fetal veya neonatal sarılık ve trombositopeni bulunur [bkz. Belirli Popülasyonlarda Kullanım ].
Hacim veya Tuz Azlığı Olan Hastalarda Hipotansiyon
Hacim veya tuz eksikliği olan hastalar (örn. Yüksek doz diüretiklerle tedavi edilenler) gibi aktive edilmiş bir renin-anjiyotensin sistemi olan hastalarda, MICARDIS HCT ile tedaviye başlandıktan sonra semptomatik hipotansiyon oluşabilir. MICARDIS HCT uygulamasından önce doğru hacim veya tuz tükenmesi.
Böbrek yetmezliği
Akut böbrek yetmezliği dahil böbrek fonksiyonundaki değişikliklere, reninanjiyotensin sistemini inhibe eden ilaçlar ve diüretikler neden olabilir. Böbrek fonksiyonu kısmen renin-anjiyotensin sisteminin aktivitesine bağlı olabilen hastalar (örneğin renal arter stenozu, kronik böbrek hastalığı, şiddetli konjestif kalp yetmezliği veya hacim azalması olan hastalar) özellikle oligüri, progresif azotemi gelişme riski altında olabilir. veya MICARDIS HCT'de akut böbrek yetmezliği. Bu hastalarda böbrek fonksiyonunu periyodik olarak izleyin. MICARDIS HCT'de böbrek fonksiyonunda klinik olarak anlamlı bir azalma gelişen hastalarda tedaviyi durdurmayı veya kesmeyi düşünün.
Elektrolitler ve Metabolik Bozukluklar
Telmisartan dahil olmak üzere renin-anjiyotensin sistemini inhibe eden ilaçlar, özellikle böbrek yetmezliği, diyabet veya diğer anjiyotensin reseptör blokerleri veya ACE inhibitörleri ile kombinasyon kullanımı olan hastalarda ve serum potasyum düzeylerini yükselten diğer ilaçların eşzamanlı kullanımında hiperkalemiye neden olabilir [bkz. İLAÇ ETKİLEŞİMLERİ ].
Hidroklorotiyazid hipokalemi ve hiponatremiye neden olabilir. Tiyazidlerin magnezyumun idrarla atılımını arttırdığı gösterilmiştir; bu hipomagnezemiye neden olabilir. Hipomagnezemi, potasyum replasmanına rağmen tedavisi zor olabilen hipokalemiye neden olabilir. Serum elektrolitlerini periyodik olarak izleyin.
Telmisartan / hidroklorotiyazid kombinasyon tedavisinin kullanıldığı kontrollü çalışmalarda, 40 mg / 12.5 mg, 80 mg / 12.5 mg veya 80 mg / 25 mg uygulanan hiçbir hasta potasyum ve 1.4 mEq / L'de bir düşüş yaşamamış ve hiçbir hastada hiperkalemi görülmemiştir.
Hidroklorotiyazid, idrarla kalsiyum atılımını azaltır ve serum kalsiyumunun yükselmesine neden olabilir.
Hidroklorotiyazid, glukoz toleransını değiştirebilir ve serum kolesterol ve trigliserit düzeylerini yükseltebilir.
Tiyazid tedavisi alan bazı hastalarda hiperürisemi meydana gelebilir veya açık gut gelişebilir. Telmisartan ürik asidi azalttığı için, telmisartan hidroklorotiyazid ile kombinasyon halinde diüretiğe bağlı hiperürisemiyi azaltır.
Aşırı duyarlılık reaksiyonu
Hidroklorotiyazid
Hidroklorotiyazide karşı aşırı duyarlılık reaksiyonları, alerji veya bronşiyal astım öyküsü olan veya olmayan hastalarda meydana gelebilir, ancak bu tür bir öyküsü olan hastalarda daha olasıdır [bkz. KONTRENDİKASYONLAR ].
Akut Miyopi ve İkincil Açı Kapanması Glokomu
Bir sülfonamid olan hidroklorotiyazid, kendine özgü bir reaksiyona neden olarak akut geçici miyopi ve akut açı kapanması glokomuna neden olabilir. Semptomlar, görme keskinliğinde azalma veya oküler ağrının akut başlangıcını içerir ve tipik olarak ilacın başlamasından saatler ila haftalar sonra ortaya çıkar. Tedavi edilmeyen akut açı kapanması glokomu kalıcı görme kaybına neden olabilir. Birincil tedavi, hidroklorotiyazidin olabildiğince hızlı bir şekilde kesilmesidir. Göz içi basıncı kontrol edilmezse, acil tıbbi veya cerrahi tedavilerin dikkate alınması gerekebilir. Akut angleclosure glokom gelişimine yönelik risk faktörleri, sülfonamid veya penisilin alerjisi öyküsünü içerebilir.
Sistemik lupus eritematoz
Tiyazid diüretiklerinin sistemik lupus eritematozusun alevlenmesine veya aktivasyonuna neden olduğu bildirilmiştir.
Postempatektomi Hastaları
Hidroklorotiyazidin antihipertansif etkileri, sempatektomi sonrası hastada artabilir.
Hasta Danışma Bilgileri
Hastaya FDA onaylı hasta etiketini okumasını önerin ( HASTA BİLGİSİ ).
Gebelik
Hamilelik sırasında MICARDIS HCT'ye maruz kalmanın sonuçları hakkında doğurganlık çağındaki kadın hastalara tavsiyelerde bulunun. Hamile kalmayı planlayan kadınlarla tedavi seçeneklerini tartışın. Hastalara gebeliklerini mümkün olan en kısa sürede doktorlarına bildirmelerini söyleyin [bkz. UYARILAR VE ÖNLEMLER ve Belirli Popülasyonlarda Kullanım ].
Emzirme
Emziren kadınlara MICARDIS HCT tedavisi sırasında emzirmemelerini tavsiye edin [bkz. Belirli Popülasyonlarda Kullanım ].
Semptomatik Hipotansiyon ve Senkop
Hastalara, özellikle tedavinin ilk günlerinde baş dönmesi meydana gelebileceğini söyleyin ve bunu sağlık uzmanlarına bildirin. Hastaları, yetersiz sıvı alımının, aşırı terlemenin, ishalin veya kusmanın, baş dönmesi ve olası senkopla aynı sonuçlara yol açacak şekilde, kan basıncında aşırı bir düşüşe yol açabileceği konusunda bilgilendirin. Hastalara senkop meydana gelirse sağlık uzmanlarıyla iletişime geçmelerini tavsiye edin [bkz. UYARILAR VE ÖNLEMLER ].
Potasyum Takviyeleri
Hastalara, reçeteyi yazan sağlık uzmanına danışmadan potasyum takviyeleri veya potasyum içeren tuz ikameleri kullanmamalarını tavsiye edin [bkz. UYARILAR VE ÖNLEMLER ve İLAÇ ETKİLEŞİMLERİ ].
Akut Miyopi ve İkincil Açı Kapanması Glokomu
Hastalara MICARDIS HCT'yi bırakmalarını ve Akut Miyopi veya İkincil Açı Kapama Glokomu semptomları yaşarlarsa derhal tıbbi yardım almalarını tavsiye edin [bkz. UYARILAR VE ÖNLEMLER ].
Klinik Olmayan Toksikoloji
Karsinogenez, Mutagenez, Doğurganlıkta Bozulma
Telmisartan ve Hidroklorotiyazid
Telmisartan ve hidroklorotiyazid kombinasyonu ile herhangi bir karsinojenite, mutajenite veya fertilite çalışması yapılmamıştır.
Telmisartan
Telmisartan, farelere ve sıçanlara 2 yıla kadar diyette uygulandığında kanserojenite kanıtı yoktu. Farelere (1000 mg / kg / gün) ve sıçanlara (100 mg / kg / gün) uygulanan en yüksek dozlar, mg / m2'dir.ikitelmisartanın önerilen maksimum insan dozunun (MRHD) sırasıyla yaklaşık 59 ve 13 katıdır. Bu aynı dozların, telmisartan MRHD'si (80 mg / gün) alan insanlarda sistemik maruziyet olarak sırasıyla> 100 kez ve> 25 kez telmisartana ortalama sistemik maruziyet sağladığı gösterilmiştir.
Genotoksisite deneyleri, ne gen ne de kromozom seviyesinde telmisartan ile ilgili herhangi bir etki ortaya koymadı. Bu testler, bakteriyel mutajenite testlerini içermektedir. Salmonella ve E. coli (Ames), Çin hamsteri V79 hücreleri ile bir gen mutasyon testi, insan lenfositleri ile bir sitogenetik test ve bir fare mikronükleus testi.
Erkek ve dişi sıçanların üreme performansı üzerinde ilaçla ilgili hiçbir etki, 100 mg / kg / gün'de (uygulanan en yüksek doz), yaklaşık 13 kez, mg / m2'de kaydedilmemiştir.ikitemel, telmisartan'ın MRHD'si. Sıçandaki bu doz, insanlarda MRHD'deki ortalama sistemik maruziyetin (80 mg / gün) en az 50 katı ortalama sistemik maruziyet (gebeliğin 6. gününde belirlendiği üzere telmisartan EAA) ile sonuçlanmıştır.
Hidroklorotiyazid
Ulusal Toksikoloji Programı (NTP) gözetiminde farelerde ve sıçanlarda yürütülen iki yıllık beslenme çalışmaları, dişi farelerde (yaklaşık 600 mg / kg / gün'e kadar dozlarda) veya erkeklerde kanserojen bir hidroklorotiyazid potansiyeli kanıtı ortaya çıkarmamıştır. ve dişi sıçanlar (yaklaşık 100 mg / kg / gün'e kadar olan dozlarda). Bununla birlikte NTP, erkek farelerde hepatokarsinojenisite için şüpheli kanıtlar buldu.
Hidroklorotiyazid genotoksik değildi laboratuvar ortamında Ames mutajenite analizinde Salmonella typhimurium TA 98, TA 100, TA 1535, TA 1537 ve TA 1538 suşları ve kromozom sapmaları için Çin Hamster Yumurtalık (CHO) testinde veya in vivo fare germinal hücre kromozomları, Çin hamsteri kemik iliği kromozomları ve Meyve sineği cinsiyete bağlı resesif öldürücü özellik geni. Pozitif test sonuçları elde edilmiştir. laboratuvar ortamında CHO Kardeş Kromatid Değişimi (klastojenite) testi, Fare Lenfoma Hücresi (mutajenite) testinde ve Aspergillus nidulans ayrılmayan tahlil.
Hidroklorotiyazid, bu türlerin çiftleşmeden önce ve gebelik süresince diyetleri yoluyla sırasıyla 100 ve 4 mg / kg dozlara kadar maruz bırakıldığı çalışmalarda, her iki cinsten farelerin ve sıçanların doğurganlığı üzerinde hiçbir olumsuz etkiye sahip değildi.
Belirli Popülasyonlarda Kullanım
Gebelik
Risk Özeti
MICARDIS HCT hamile bir kadına uygulandığında fetal zarara neden olabilir. Gebeliğin ikinci ve üçüncü trimesterinde renin-anjiyotensin sistemine etki eden ilaçların kullanımı fetal böbrek fonksiyonunu azaltır ve fetal ve neonatal morbidite ve ölümü artırır (bkz. Klinik Hususlar ). İlk trimesterde antihipertansif kullanıma maruz kaldıktan sonra fetal anormallikleri inceleyen epidemiyolojik çalışmaların çoğu, renin-anjiyotensin sistemini etkileyen ilaçları diğer antihipertansif ajanlardan ayırt etmemiştir. Telmisartan ile sıçan ve tavşanlarda yapılan çalışmalar, yalnızca maternal olarak toksik dozlarda fetotoksisite göstermiştir (bkz. Veri ). Gebelik tespit edildiğinde, MICARDIS HCT'yi mümkün olan en kısa sürede sonlandırın.
Belirtilen popülasyon için büyük doğum kusurları ve düşüklerin tahmini arka plan riski bilinmemektedir. Tüm gebeliklerin arka planda doğum kusuru, kayıp veya diğer olumsuz sonuçlar riski vardır. ABD genel popülasyonunda, klinik olarak tanınan gebeliklerde büyük doğum kusurları ve düşüklerin tahmini arka plan riski sırasıyla% 2 ila% 4 ve% 15 ila% 20'dir.
Klinik Hususlar
Hastalıkla ilişkili maternal ve / veya embriyo / fetal risk
Gebelikte hipertansiyon, annenin preeklampsi, gestasyonel diyabet, erken doğum ve doğum komplikasyonları (örneğin, sezaryen ihtiyacı ve doğum sonrası kanama) riskini artırır. Hipertansiyon, intrauterin büyüme kısıtlaması ve intrauterin ölüm için fetal riski artırır. Hipertansiyonu olan hamile kadınlar dikkatle izlenmeli ve buna göre yönetilmelidir.
Fetal / Neonatal advers reaksiyonlar
Telmisartan
Gebeliğin ikinci ve üçüncü trimesterlerinde RAS üzerinde etkili olan ilaçların kullanımı şunlara neden olabilir: oligohidramniyos, anüri ve böbrek yetmezliğine yol açan fetal böbrek fonksiyonunda azalma, fetal akciğer hipoplazisi, kafatası hipoplazisi dahil iskelet deformasyonları, hipotansiyon ve ölüm . Belirli bir hasta için renin-anjiyotensin sistemini etkileyen ilaçlarla tedaviye uygun bir alternatifin bulunmadığı alışılmadık bir durumda, anneye fetüse yönelik potansiyel risk söz konusudur.
Hamilelik sırasında MICARDIS HCT alan hastalarda, intra-amniyotik ortamı değerlendirmek için seri ultrason muayeneleri yapın. Gebelik haftasına göre fetal testler uygun olabilir. Oligohidramnios gözlenirse, anne için hayat kurtarıcı olarak kabul edilmediği sürece MICARDIS HCT'yi sonlandırın. Bununla birlikte, hastalar ve doktorlar, oligohidramniyosun, fetüsün geri dönüşü olmayan bir hasar görene kadar ortaya çıkmayabileceğinin farkında olmalıdır.
Geçmişi olan bebekleri yakından izleyin. rahimde hipotansiyon, oligüri ve hiperkalemi için MICARDIS HCT'ye maruz kalma. Oligüri veya hipotansiyon oluşursa, kan basıncını ve renal perfüzyonu destekleyin. Hipotansiyonu tersine çevirmenin ve böbrek fonksiyonunu değiştirmenin bir yolu olarak kan değişimi veya diyaliz gerekebilir [bkz. Belirli Popülasyonlarda Kullanım ].
Hidroklorotiyazid
Tiyazidler plasentayı geçer ve hamilelik sırasında tiyazidlerin kullanımı fetal veya neonatal sarılık, trombositopeni ve yetişkinlerde meydana gelen olası diğer yan etkiler riski ile ilişkilidir.
Veri
Hayvan Verileri
MICARDIS HCT
3.2 / 1.0, 15 / 4.7, 50 / 15.6 ve 0 / 15.6 mg / kg / gün telmisartan / hidroklorotiyazid dozlarına sahip sıçanlarda gelişimsel toksisite çalışması yapılmıştır. İki yüksek doz kombinasyonu, her iki ilaca göre anneler için daha toksik (vücut ağırlığı artışında önemli azalma) görünse de, gelişen embriyolarda toksisitede bir artış görülmedi.
Telmisartan
Gebe sıçanlara 50 mg / kg / gün'e kadar oral dozlarda ve gebe tavşanlara 45 mg / kg / gün'e kadar oral dozlarda telmisartan uygulandığında teratojenik etki gözlenmemiştir. Tavşanlarda, 45 mg / kg / gün'de maternal toksisite (azaltılmış vücut ağırlığı artışı ve gıda tüketimi) ile ilişkili embriyo letalitesi (mg / m2'de 80 mg'lık maksimum önerilen insan dozunun [MRHD] yaklaşık 12 katıikitemeli). Sıçanlarda maternal olarak toksik (azaltılmış vücut ağırlığı artışı ve gıda tüketimi) telmisartan dozları 15 mg / kg / gün (mg / m2'de MRHD'nin yaklaşık 1.9 katı)ikigebeliğin sonlarında ve emzirme döneminde uygulanan), yenidoğanlarda canlılığın azalması, düşük doğum ağırlığı, gecikmiş olgunlaşma ve kilo alımında azalma dahil olmak üzere olumsuz etkiler ürettiği gözlemlenmiştir. Sıçanlarda ve tavşanlarda gelişimsel toksisite için gözlenmeyen etki dozları sırasıyla 5 ve 15 mg / kg / gün, mg / m2'de sırasıyla yaklaşık 0.64 ve 3.7 kattır.ikitemel olarak, telmisartanın MRHD'si (80 mg / gün).
Hidroklorotiyazid
Hidroklorotiyazidin gebe farelere ve sıçanlara sırasıyla 3000 ve 1000 mg / kg / gün'e kadar dozlarda (MRHD'nin yaklaşık 600 ve 400 katı) ilgili majör organogenez dönemlerinde uygulandığı çalışmalar, fetüse herhangi bir zarar kanıtı sağlamamıştır. .
Tiyazidler plasentayı geçebilir ve umbilikal vende ulaşılan konsantrasyonlar maternal plazmadakilere yaklaşır. Hidroklorotiyazid, diğer diüretikler gibi plasental hipoperfüzyona neden olabilir. Umbilikal ven plazmasındakinin 19 katına kadar bildirilen konsantrasyonlarla amniyotik sıvıda birikir. Gebelik sırasında tiyazidlerin kullanımı, fetal veya neonatal sarılık veya trombositopeni riski ile ilişkilidir. EPH (Ödem, Proteinüri, Hipertansiyon) gestoz (preeklampsi) seyrini engellemediği veya değiştirmediği için bu ilaçlar gebelerde hipertansiyonu tedavi etmek için kullanılmamalıdır. Hidroklorotiyazidin gebelikte diğer endikasyonlar için (örn. Kalp hastalığı) kullanımından kaçınılmalıdır.
Emzirme
Risk Özeti
İnsan sütünde MICARDIS HCT veya telmisartanın varlığı, anne sütüyle beslenen bebek üzerindeki etkileri veya süt üretimi üzerindeki etkileri hakkında bilgi yoktur. Sınırlı yayınlanmış çalışmalar, hidroklorotiyazidin insan sütünde bulunduğunu bildirmektedir. Ancak hidroklorotiyazidin anne sütüyle beslenen bebek üzerindeki etkilerini veya hidroklorotiyazidin süt üretimi üzerindeki etkilerini belirlemek için yeterli bilgi bulunmamaktadır. Telmisartan, emziren sıçanların sütünde bulunur. (görmek Veri ). Emzirilen bebekte hipotansiyon, hiperkalemi ve böbrek yetmezliği gibi ciddi advers reaksiyon potansiyeli nedeniyle, emziren bir kadına MICARDIS HCT tedavisi sırasında emzirmemesini önerin.
Veri
Telmisartan, emziren sıçanların sütünde, uygulamadan 4 ila 8 saat sonra plazmada bulunanların 1.5 ila 2 katı konsantrasyonlarda mevcuttu.
Pediatrik Kullanım
Pediyatrik hastalarda MICARDIS HCT'nin güvenliği ve etkinliği belirlenmemiştir.
MICARDIS HCT'ye Utero Maruz Kalma Geçmişi Olan Yenidoğanlar
Oligüri veya hipotansiyon oluşursa, kan basıncını ve renal perfüzyonu destekleyin. Hipotansiyonu tersine çevirme ve / veya bozuk böbrek fonksiyonunun yerine geçme aracı olarak değişim transfüzyonları veya diyaliz gerekebilir.
Geriatrik Kullanım
Kontrollü klinik çalışmalarda (n = 1017), telmisartan / hidroklorotiyazid ile tedavi edilen hastaların yaklaşık% 20'si 65 yaşında veya daha büyüktü ve% 5'i 75 yaşında veya daha büyüktü. Genç hastalara kıyasla bu hastalarda telmisartan / hidroklorotiyazidin etkililiği ve güvenliliği açısından genel bir farklılık gözlenmemiştir. Bildirilen diğer klinik deneyimler, yaşlılar ve daha genç hastalar arasındaki yanıtlardaki farklılıkları belirlememiştir, ancak bazı yaşlı bireylerin daha fazla duyarlılığı göz ardı edilemez. Genel olarak, yaşlı bir hasta için doz seçimi, genellikle dozaj aralığının alt ucundan başlayarak, daha fazla sıklıkta azalmış karaciğer, böbrek veya kalp fonksiyonu ve eşlik eden hastalıklar veya diğer ilaç tedavilerini yansıtan ihtiyatlı olmalıdır.
Karaciğer Bozukluğu Olan Hastalarda Kullanım
Safra tıkanıklığı bozuklukları veya karaciğer yetmezliği olan hastalar, 40 mg / 12,5 mg kombinasyonunu kullanarak yakın tıbbi gözetim altında tedaviye başlamalıdır.
Telmisartan
Telmisartanın çoğu safra atılımı ile elimine edildiğinden, safra tıkanıklığı bozuklukları veya karaciğer yetmezliği olan hastaların klerensinin azalması ve daha yüksek kan seviyelerine sahip olması beklenebilir.
Hidroklorotiyazid
Karaciğer fonksiyon bozukluğu veya ilerleyici karaciğer hastalığı olan hastalarda sıvı ve elektrolit dengesindeki küçük değişiklikler hepatik komayı hızlandırabilir.
Böbrek Yetmezliği Olan Hastalarda Kullanım
Şiddetli böbrek yetmezliği (CrCl & le; 30 mL / dak) olan hastalarda MICARDIS HCT'nin güvenliği ve etkinliği belirlenmemiştir. Şiddetli böbrek yetmezliği olan hastalarda MICARDIS HCT tabletleri önerilmemektedir. Hafif (CrCl 60 ila 90 mL / dak) veya orta (CrCl 30 ila 60 mL / dak) böbrek yetmezliği olan hastalarda doz ayarlaması gerekmez.
Doz aşımı ve KontrendikasyonlarDOZ AŞIMI
Telmisartan
İnsanlarda telmisartanın doz aşımına ilişkin sınırlı veri mevcuttur. Telmisartan ile doz aşımının en olası belirtileri hipotansiyon, baş dönmesi ve taşikardidir; bradikardi, parasempatik (vagal) stimülasyondan kaynaklanabilir. Semptomatik hipotansiyon meydana gelirse, destekleyici tedavi başlatılmalıdır. Telmisartan hemodiyaliz ile uzaklaştırılmaz.
Hidroklorotiyazid
Hidroklorotiyazid doz aşımına sahip hastalarda en yaygın görülen belirti ve semptomlar, elektrolit tükenmesi (hipokalemi, hipokloremi, hiponatremi) ve aşırı diürezden kaynaklanan dehidrasyondur. Digitalis de uygulanmışsa, hipokalemi kardiyak aritmileri artırabilir. Hidroklorotiyazidin hemodiyalizle uzaklaştırılma derecesi belirlenmemiştir. Hidroklorotiyazidin oral LD'si hem farelerde hem de sıçanlarda 10 g / kg'dan daha büyüktür.
KONTRENDİKASYONLAR
MICARDIS HCT kontrendikedir:
- Bu ürünün herhangi bir bileşenine aşırı duyarlı olan hastalarda [bkz. UYARILAR VE ÖNLEMLER ].
- Anüri hastalarında.
- Diyabetli hastalarda aliskiren ile birlikte uygulama için [bkz. İLAÇ ETKİLEŞİMLERİ ].
KLİNİK FARMAKOLOJİ
Hareket mekanizması
MICARDIS HCT
MICARDIS HCT, antihipertansif özelliklere sahip iki ilacın kombinasyonudur: bir tiazid diüretik, hidroklorotiyazid ve bir anjiyotensin II reseptör bloker (ARB), telmisartan.
Telmisartan
Anjiyotensin II, anjiyotensin dönüştürücü enzim (ACE, kininaz II) tarafından katalize edilen bir reaksiyonda anjiyotensin I'den oluşur. Anjiyotensin II, renin-anjiyotensin sisteminin başlıca baskılayıcı ajanıdır ve vazokonstriksiyon, aldosteron sentezinin uyarılması ve salınması, kardiyak stimülasyon ve sodyumun renal reabsorpsiyonunu içeren etkileri vardır. Telmisartan, anjiyotensin II'nin AT'ye bağlanmasını seçici olarak bloke ederek, anjiyotensin II'nin vazokonstriktör ve aldosteron salgılayıcı etkilerini bloke eder.birvasküler düz kas ve adrenal bez gibi birçok dokudaki reseptör. Bu nedenle etkisi, anjiyotensin II sentezi yollarından bağımsızdır.
Ayrıca bir AT varikireseptör birçok dokuda bulunur, ancak ATikikardiyovasküler homeostaz ile ilişkili olduğu bilinmemektedir. Telmisartan, AT için çok daha fazla afiniteye (> 3.000 kat) sahiptir.birAT için olduğundan daha reseptörikialıcı.
Telmisartan, ACE'yi (kininaz II) inhibe etmez ve kardiyovasküler düzenlemede önemli olduğu bilinen diğer hormon reseptörlerine veya iyon kanallarına bağlanmaz veya bunları bloke etmez.
Anjiyotensin II reseptörünün blokajı, anjiyotensin II'nin renin sekresyonu üzerindeki negatif düzenleyici geri bildirimini inhibe eder, ancak sonuçta ortaya çıkan plazma renin aktivitesi ve anjiyotensin II dolaşım seviyeleri, telmisartanın kan basıncı üzerindeki etkisinin üstesinden gelmez.
Hidroklorotiyazid
Hidroklorotiyazid bir tiyazid diüretiktir. Tiyazidler, elektrolit geri emiliminin renal tübüler mekanizmalarını etkileyerek, yaklaşık olarak eşdeğer miktarlarda sodyum tuzu ve klorür atılımını doğrudan arttırır. Dolaylı olarak, hidroklorotiyazidin diüretik etkisi plazma hacmini düşürür, bunun sonucunda plazma renin aktivitesinde artış, aldosteron sekresyonunda artış, idrar potasyum kaybında artış ve serum potasyumunda azalma. Renin-aldosteron bağlantısına anjiyotensin II aracılık eder, bu nedenle bir ARB'nin birlikte uygulanması, bu diüretiklerle ilişkili potasyum kaybını tersine çevirme eğilimindedir. Tiyazidlerin antihipertansif etkisinin mekanizması tam olarak anlaşılmamıştır.
Farmakodinamik
Telmisartan
Normal gönüllülerde 80 mg telmisartan dozu, anjiyotensin II'nin intravenöz infüzyonuna baskı yanıtını, en yüksek plazma konsantrasyonlarında yaklaşık% 90 oranında inhibe etti ve yaklaşık% 40 inhibisyon 24 saat boyunca devam etti.
Plazma anjiyotensin II konsantrasyonu ve plazma renin aktivitesi, sağlıklı deneklere tek telmisartan uygulamasından ve hipertansif hastalara tekrarlı uygulamadan sonra doza bağlı bir şekilde artmıştır. Sağlıklı gönüllülere günde bir kez 80 mg telmisartanın uygulanması, plazma aldosteron konsantrasyonlarını etkilememiştir. Hipertansif hastalarla yapılan çoklu doz çalışmalarında, elektrolitlerde (serum potasyumu veya sodyum) veya metabolik fonksiyonda (kolesterol, trigliseritlerin, HDL, LDL, glikoz veya ürik asitin serum seviyeleri dahil) klinik olarak önemli bir değişiklik olmamıştır.
Telmisartanın antihipertansif etkileri, 1031'i telmisartan ile tedavi edilen, hafif ila orta derecede hipertansiyonlu (diyastolik kan basıncı 95 ila 114 mmHg) toplam 1773 hasta dahil olmak üzere altı plasebo kontrollü klinik çalışmada incelenmiştir. Telmisartanın günde bir kez uygulanmasını takiben, plasebo çıkarıldıktan sonra başlangıca göre kan basıncındaki düşüşün büyüklüğü, 20 mg için yaklaşık olarak (SBP / DBP) 6-8 / 6 mmHg, 40 mg için 9-13 / 6-8 mmHg ve 12 80 mg için -13 / 7-8 mmHg. Daha büyük dozların (160 mg'a kadar) kan basıncında daha fazla düşüşe neden olduğu görülmedi.
Antihipertansif aktivitenin başlangıcı, yaklaşık 4 hafta maksimum azalma ile 3 saat içinde ortaya çıkar. 20, 40 ve 80 mg'lık dozlarda, günde bir kez telmisartan uygulamasının antihipertansif etkisi, tam 24 saatlik doz aralığı boyunca korunmuştur.
Hidroklorotiyazid 12.5 mg ile kombinasyon halinde 80 mg telmisartan veya 80 mg telmisartan ile 8 hafta süreyle tedavi edilen normal böbrek fonksiyonuna sahip 30 hipertansif hastada, renal kan akışında, glomerüler filtrasyon hızında, filtrasyon fraksiyonunda, renovasküler dirençte başlangıca göre klinik olarak anlamlı bir değişiklik olmamıştır, veya kreatinin klirensi.
Hidroklorotiyazid
Hidroklorotiyazidin oral uygulamasından sonra diürez 2 saat içinde başlar, yaklaşık 4 saat içinde zirve yapar ve yaklaşık 6 ila 12 saat sürer.
İlaç etkileşimleri
Hidroklorotiyazid
Alkol, barbitüratlar veya narkotikler
Ortostatik hipotansiyonun güçlenmesi meydana gelebilir.
İskelet kası gevşeticileri
Kürar türevleri gibi kas gevşetici maddelere olası artan yanıt.
Kortikosteroidler, ACTH
Yoğun elektrolit tükenmesi, özellikle hipokalemi.
Presör aminler (ör. Norepinefrin)
Presör aminlere olası azalan yanıt, ancak kullanımlarını engellemeye yeterli değildir.
Farmakokinetik
Telmisartan
Emilim:
Oral uygulamayı takiben, zirve telmisartan konsantrasyonlarına (Cmax) doz uygulamasından 0.5 ila 1 saat sonra ulaşılır. Yiyecekler, telmisartanın biyoyararlanımını, plazma konsantrasyon-zaman eğrisi (EAA) altındaki alanda 40 mg ile yaklaşık% 6 ve 160 mg dozdan sonra yaklaşık% 20 azalma ile hafifçe azaltır. MICARDIS HCT, yiyecekle birlikte veya yiyeceksiz uygulanabilir. Telmisartanın mutlak biyoyararlanımı doza bağlıdır. 40 ve 160 mg'da biyoyararlanım sırasıyla% 42 ve% 58 idi. Ağızdan uygulanan MICARDIS ile telmisartanın farmakokinetiği, 20 ila 160 mg doz aralığında doğrusal değildir ve artan dozlar ile orantılı plazma konsantrasyonlarında (Cmaks ve EAA) daha fazla artış vardır. Telmisartan, yaklaşık 24 saatlik bir terminal eliminasyon yarı ömrü ile iki üstel bozulma kinetiği gösterir. Günde bir kez dozlama ile telmisartanın dip plazma konsantrasyonları, doruk plazma konsantrasyonlarının yaklaşık% 10 ila% 25'idir. Telmisartan, günde bir kez tekrarlanan dozlamadan sonra plazmada 1.5 ila 2.0 arasında bir birikim indeksine sahiptir.
Dağıtım:
Telmisartan, başta albümin ve α olmak üzere plazma proteinlerine (>% 99,5) yüksek oranda bağlanır.bir-asit glikoprotein. Plazma proteinlerine bağlanma, önerilen dozlarla elde edilen konsantrasyon aralığı üzerinde sabittir. Telmisartan için dağılım hacmi yaklaşık 500 litredir ve bu da ek doku bağlanmasını gösterir.
Metabolizma:
Telmisartan, farmakolojik olarak inaktif bir asil glukuronid oluşturmak üzere konjugasyon yoluyla metabolize edilir; ana bileşiğin glukuronidi, insan plazması ve idrarında tanımlanan tek metabolittir. Tek bir dozdan sonra, glukuronid, plazmada ölçülen radyoaktivitenin yaklaşık% 11'ini temsil eder. Sitokrom P450 izoenzimleri, telmisartan metabolizmasında yer almaz.
Eliminasyon:
İntravenöz veya oral uygulamadan sonra14C-işaretli telmisartan, uygulanan dozun çoğu (>% 97) safra atılımı yoluyla dışkıda değişmeden elimine edildi; idrarda sadece dakika miktarları bulundu (sırasıyla toplam radyoaktivitenin% 0.91 ve% 0.49'u).
Telmisartanın toplam plazma klirensi> 800 mL / dakikadır. Terminal yarılanma ömrü ve toplam klirens, dozdan bağımsız görünmektedir.
Hidroklorotiyazid
Hidroklorotiyazid metabolize edilmez ancak böbrekler tarafından hızla atılır. Plazma seviyeleri en az 24 saat izlendiğinde, plazma yarı ömrünün 5,6 ile 14,8 saat arasında değiştiği gözlemlenmiştir. Oral dozun en az% 61'i 24 saat içinde değişmeden atılır.
Hidroklorotiyazid plasentayı geçer ancak kan-beyin bariyerini geçmez ve anne sütüne geçer.
Belirli Popülasyonlar
Telmisartan
Böbrek yetmezliği
Telmisartan hemofiltrasyon yoluyla kandan uzaklaştırılmaz [bkz. UYARILAR VE ÖNLEMLER , ve Belirli Popülasyonlarda Kullanım ].
Karaciğer Yetmezliği
Karaciğer yetmezliği olan hastalarda, telmisartanın plazma konsantrasyonları artar ve mutlak biyoyararlanım% 100'e yaklaşır [bkz. Belirli Popülasyonlarda Kullanım ].
Cinsiyet
Telmisartanın plazma konsantrasyonları genellikle kadınlarda erkeklere göre 2 ila 3 kat daha yüksektir. Bununla birlikte, klinik çalışmalarda, kadınlarda kan basıncı yanıtında veya ortostatik hipotansiyon insidansında önemli bir artış bulunmamıştır. Doz ayarlaması gerekli değildir.
Geriatrik Hastalar
Telmisartanın farmakokinetiği, yaşlılar ve 65 yaşın altındakiler arasında farklılık göstermez.
İlaç Etkileşim Çalışmaları
Telmisartan
Ramipril
Günde bir kez 80 mg telmisartan ve günde bir kez 10 mg ramiprilin birlikte uygulanması ramiprilin kararlı durum Cmaks ve EAA'sını sırasıyla 2,3 ve 2,1 kat ve ramiprilatın Cmaks ve EAA değerlerini sırasıyla 2,4 ve 1,5 kat artırır. . Buna karşılık, telmisartanın Cmaks ve EAA değeri sırasıyla% 31 ve% 16 azalır. Telmisartan ve ramipril birlikte uygulandığında, yanıt, kombine ilaçların olası ilave farmakodinamik etkilerinden ve ayrıca telmisartan varlığında ramipril ve ramiprilata artan maruziyet nedeniyle daha büyük olabilir.
Diğer uyuşturucular
Telmisartanın birlikte uygulanması, asetaminofen, amlodipin, gliburit, simvastatin, hidroklorotiyazid, varfarin veya ibuprofen ile klinik olarak anlamlı bir etkileşime neden olmamıştır. Telmisartan, sitokrom P450 sistemi tarafından metabolize edilmez ve etkisi yoktur. laboratuvar ortamında CYP2C19'un bir miktar inhibisyonu dışında sitokrom P450 enzimleri üzerinde. Telmisartan'ın sitokrom P450 enzimlerini inhibe eden ilaçlarla etkileşime girmesi beklenmez; CYP2C19 tarafından metabolize edilen ilaçların metabolizmasının olası inhibisyonu dışında, sitokrom P450 enzimleri tarafından metabolize edilen ilaçlarla etkileşmesi de beklenmemektedir.
Klinik çalışmalar
Telmisartan ve Hidroklorotiyazid
2500'den fazla hipertansif hastayla yapılan kontrollü klinik çalışmalarda, 1017 hasta telmisartan (20 mg ila 160 mg) ve eşzamanlı hidroklorotiyazide (6.25 mg ila 25 mg) maruz bırakılmıştır. Bu denemeler, telmisartan (20 mg, 40 mg, 80 mg, 160 mg veya plasebo) ve hidroklorotiyazid (6.25 mg, 12.5 mg, 25 mg ve plasebo) kombinasyonları ile bir faktöriyel denemeyi (Çalışma 1) içeriyordu. Faktöriyel deneme 493 (% 60) erkek dahil 818 hastayı randomize etti; 596 (% 73) Siyah Olmayan ve 222 (% 27) Siyahlar; ve 143 (% 18) & ge; 65 yaş (medyan yaş 53 idi). Toplam popülasyon için başlangıçtaki ortalama sırtüstü kan basıncı 154/101 mmHg idi.
Telmisartan ve hidroklorotiyazid kombinasyonu, 9-13 ile karşılaştırıldığında 40 mg / 12,5 mg ve 80 mg / 25 mg arasındaki dozlar için 16-21 / 9-11 mmHg çukurda sistolik ve diyastolik kan basınçlarında aditif, plaseboya göre ayarlanmış azalmalara neden olmuştur. / Telmisartan 40 mg ila 80 mg monoterapi için 7-8 mmHg ve hidroklorotiyazid 12.5 mg monoterapi için 4/4 mmHg. Antihipertansif etki yaş veya cinsiyetten bağımsızdı. Plasebo kontrollü çalışmada telmisartan ve hidroklorotiyazid kombinasyonu ile tedavi edilen hastalarda kalp hızında esasen bir değişiklik olmamıştır.
En az altı aylık hipertansif hastalarla yapılan diğer dört çalışma, randomize telmisartan monoterapi dozu üzerinde yeterince kontrol edilmeyen veya telmisartan titrasyonunu tamamladıktan sonra yeterli kan basıncı yanıtına ulaşamayan hastalar için hidroklorotiyazid eklenmesine izin verdi. Aktif kontrollü çalışmalarda, telmisartan monoterapisi ile yeterli yanıtı elde edemeyen veya sürdüren hastalarda titre edilmiş telmisartan dozlarına 12,5 mg hidroklorotiyazidin eklenmesi, sistolik ve diyastolik kan basınçlarını daha da azaltmıştır.
İlaç RehberiHASTA BİLGİSİ
MICARDIS HCT
(my-CAR-dis HCT)
(telmis artan ve hidroklorotiyazid) Tabletler
MICARDIS HCT tabletlerini almaya başlamadan önce ve her tekrar doldurduğunuzda bu Hasta Bilgilerini okuyun. Yeni bilgiler olabilir. Bu bilgi, doktorunuzla tıbbi durumunuz veya tedaviniz hakkında konuşmanın yerini almaz.
MICARDIS HCT tabletleri hakkında bilmem gereken en önemli bilgi nedir?
MICARDIS HCT, doğmamış bir bebeğe zarar verebilir veya ölüme neden olabilir. Hamile kalmayı planlıyorsanız, kan basıncınızı düşürmenin diğer yolları hakkında doktorunuzla konuşun. MICARDIS HCT alırken hamile kalırsanız, derhal doktorunuza söyleyin.
MICARDIS HCT nedir?
MICARDIS HCT, yüksek tansiyonu (hipertansiyon) tedavi etmek için kullanılan reçeteli bir ilaçtır.
MICARDIS HCT şunları içerir:
- bir anjiyotensin reseptör bloker olan telmisartan (ARB)
- hidroklorotiyazid, bir su hapı veya diüretik
Doktorunuz, yüksek tansiyonunuzu tedavi etmek için MICARDIS HCT ile birlikte almanız için başka ilaçlar yazabilir.
MICARDIS HCT'nin çocuklarda güvenli ve etkili olup olmadığı bilinmemektedir.
Aşağıdaki durumlarda MICARDIS HCT tabletlerini almayın:
- düşük idrar çıkışı var veya hiç yok
- aktif bileşenlere (telmisartan veya hidroklorotiyazid) veya bu broşürün sonunda listelenen diğer bileşenlerden herhangi birine alerjik (aşırı duyarlı)
MICARDIS HCT tabletlerini kullanmadan önce doktoruma ne söylemeliyim?
MICARDIS HCT tabletlerini almadan önce doktorunuza söyleyin:
- Hamile iseniz veya hamile kalmayı planlıyorsanız. Görmek 'MICARDIS HCT tabletleri hakkında bilmem gereken en önemli bilgi nedir?'
- emziriyorsanız veya emzirmeyi planlıyorsanız. MICARDIS HCT anne sütünüze geçebilir ve bebeğinize zarar verebilir. MICARDIS HCT'yi mi yoksa emzirmeyi mi alacağınıza siz ve doktorunuz karar vermelisiniz. İkisini birden yapmamalısın. MICARDIS HCT tabletleri alırsanız bebeğinizi beslemenin en iyi yolu hakkında doktorunuzla konuşun.
- Kanınızda anormal vücut tuzu (elektrolit) seviyeleri olduğu söylendi
- karaciğer problemleri var
- astım veya astım öyküsü var
- Lupus var
- diyabet var
- böbrek problemleri var
- başka herhangi bir tıbbi durumunuz var
Doktorunuza aldığınız tüm ilaçları anlatın, reçeteli ve reçetesiz ilaçlar, vitaminler ve bitkisel takviyeler dahil. Ayrıca alkol içiyorsanız doktorunuza söyleyin.
MICARDIS HCT, diğer ilaçların çalışma şeklini etkileyebilir ve diğer ilaçlar MICARDIS HCT'nin çalışma şeklini etkileyebilir. Özellikle şunları alırsanız doktorunuza söyleyin:
- Aliskiren
- digoksin (Lanoxin)
- lityum (Lithobid, lityum karbonat, lityum sitrat)
- yüksek tansiyonunuzu veya kalp probleminizi tedavi etmek için kullanılan diğer ilaçlar
- su hapları (idrar söktürücü)
- aspirin veya diğer steroidal olmayan antiinflamatuar ilaçlar (NSAID'ler)
- potasyum takviyeleri veya potasyum içeren bir tuz ikamesi
- insülin dahil diyabet tedavisinde kullanılan ilaç
- narkotik ağrı kesici ilaçlar
- uyku hapları
- steroid ilaç veya Adrenokortikotrofik Hormon (ACTH)
- barbitüratlar
- belirli kolesterol düşürücü ilaçlar (kolesterolü düşürmek için kullanılan reçineler, örneğin kolestiramin ve kolestipol reçineleri)
Yukarıda listelenen ilaçlardan birini alıp almadığınızı doktorunuza sorun.
Aldığınız ilaçları bilin. Bunların bir listesini tutun ve yeni bir ilaç aldığınızda doktorunuza veya eczacınıza gösterin.
MICARDIS HCT tabletlerini nasıl almalıyım?
- MICARDIS HCT tabletlerini tam olarak doktorunuzun size almanızı söylediği şekilde alın.
- Doktorunuz size MICARDIS HCT'yi ne kadar ve ne zaman alacağınızı söyleyecektir.
- Doktorunuz size söylemediği sürece dozunuzu değiştirmeyin.
- MICARDIS HCT'yi günde bir kez alın.
- MICARDIS HCT tabletlerini yiyecekle birlikte veya yemeksiz alın.
- Çok fazla MICARDIS HCT alırsanız, doktorunuzu arayın veya hemen en yakın hastanenin acil servisine gidin.
- Okumak 'Kabarcık nasıl açılır' MICARDIS HCT'yi kullanmadan önce bu broşürün sonunda. Talimatları anlamadıysanız doktorunuzla konuşun.
MICARDIS HCT tabletlerinin olası yan etkileri nelerdir?
MICARDIS HCT tabletleri aşağıdakiler dahil ciddi yan etkilere neden olabilir:
- Doğmamış bebeğinizin yaralanması veya ölmesi. Görmek 'MICARDIS HCT tabletleri hakkında bilmem gereken en önemli bilgi nedir?'
- Düşük tansiyon (hipotens iyonu) büyük olasılıkla şu durumlarda da meydana gelir:
- su hapları al (diüretikler)
- az tuzlu diyet yapıyorlar
- diyaliz tedavisi almak
- kalp problemleri var
- kusma veya ishal ile hastalanmak
- yeterince sıvı içmeyin
- çok terlemek
- Böbrek sorunları , Halihazırda böbrek hastalığınız varsa bu daha da kötüleşebilir. Böbrek testi sonuçlarınızda değişiklikler olabilir ve daha düşük dozda MICARDIS HCT tabletlerine ihtiyacınız olabilir. Aşağıdaki durumlarda doktorunuzu arayın:
- ayaklarınızda, ayak bileklerinizde veya ellerinizde şişme
- açıklanamayan kilo alımı
- Karaciğer sorunları , Halihazırda karaciğer problemleri olan ve MICARDIS HCT alan kişilerde daha da kötüleşebilir.
- Göz problemleri . MICARDIS HCT'deki ilaçlardan biri görme kaybına neden olabilecek göz problemlerine neden olabilir. MICARDIS'e başladıktan saatler veya haftalar sonra göz problemlerinin belirtileri ortaya çıkabilir.
HCT. Varsa hemen doktorunuza söyleyin:
- görüşte azalma
- göz ağrısı
- Alerjik reaksiyonlar . Bu belirtilerden herhangi birini yaşarsanız hemen doktorunuza söyleyin:
- yüz, dil, boğazda şişme
- nefes almada zorluk
- Sosis veya lupus. MICARDIS HCT alırken lupusunuz kötüleşirse veya aktif hale gelirse doktorunuza söyleyin.
- Kan ve sıvı problemlerinizde vücut tuzları (elektrolitler) seviyesinde değişiklik. Doktorunuz kanınızı kontrol etmek için testler yapabilir. Varsa hemen doktorunuzu arayın:
- kuru ağız
- susuzluk
- yorgunluk
- uykululuk
- huzursuzluk
- bilinç bulanıklığı, konfüzyon
- nöbetler
- hızlı kalp atışları
- zayıflık
- kas ağrısı veya krampları
- çok düşük idrar çıkışı
- mide bulantısı ya da kusma
Baygınlık veya baş dönmesi hissederseniz, uzanın ve hemen doktorunuzu arayın.
Yukarıda listelenen belirtilerden herhangi birini yaşarsanız hemen doktorunuzu arayın.
MICARDIS HCT tabletlerinin en yaygın yan etkileri şunlardır:
- sinüs ağrısı / tıkanıklığı ve boğaz ağrısı dahil üst solunum yolu enfeksiyonları
- baş dönmesi
- yorgun hissetmek
- grip benzeri semptomlar
- sırt ağrısı
- ishal
- mide bulantısı
Bunlar MICARDIS HCT tabletlerinin tüm olası yan etkileri değildir. Sizi rahatsız eden veya geçmeyen herhangi bir yan etkiniz varsa doktorunuza söyleyin. Yan etkiler hakkında tıbbi tavsiye almak için doktorunuzu arayın. Yan etkileri 1-800-FDA-1088'de FDA'ya bildirebilirsiniz.
MICARDIS HCT tabletlerini nasıl saklamalıyım?
- MICARDIS HCT tabletlerini oda sıcaklığında 68 ° F ila 77 ° F (20 ° C ila 25 ° C) arasında saklayın.
- MICARDIS HCT tabletlerini, almadan hemen önce blisterlerden çıkarmayın.
MICARDIS HCT tabletlerini ve tüm ilaçları çocukların erişemeyeceği bir yerde saklayın.
MICARDIS HCT tabletleri hakkında genel bilgiler:
İlaçlar bazen Hasta Bilgilendirme broşüründe listelenenler dışındaki amaçlar için reçete edilir. MICARDIS HCT tabletlerini reçete edilmediği bir durum için kullanmayın. MICARDIS HCT tabletlerini, sizinle aynı duruma sahip olsalar bile başkalarına vermeyin. Onlara zarar verebilir.
Bu Hasta Bilgilendirme broşürü, MICARDIS HCT tabletleri hakkındaki en önemli bilgileri özetler. Daha fazla bilgi isterseniz doktorunuzla konuşun. Sağlık uzmanları için yazılan MICARDIS HCT tabletleri hakkında bilgi almak için eczacınıza veya doktorunuza danışabilirsiniz.
Güncel reçete bilgileri için aşağıdaki kodu tarayın veya 1-800-542-6257 veya (TTY) 1-800-459-9906 numaralı telefondan Boehringer Ingelheim Pharmaceuticals, Inc.'i arayın.
 |
MICARDIS HCT tabletlerindeki bileşenler nelerdir?
Aktif Bileşenler: telmisartan ve hidroklorotiyazid
Aktif Olmayan Malzemeler: sodyum hidroksit, meglumin, povidon, sorbitol, magnezyum stearat, laktoz monohidrat, mikrokristalin selüloz, mısır nişastası ve sodyum nişasta glikolat
40 mg / 12.5 mg ve 80 mg / 12.5 mg tabletler ayrıca şunları içerir: demir oksit kırmızısı.
80 mg / 25 mg tabletler ayrıca şunları içerir: ferrik oksit sarısı.
Yüksek tansiyon (hipertansiyon) nedir?
Kan basıncı, kalbiniz attığında ve dinlendiğinde kan damarlarınızdaki kuvvettir. Kuvvet çok fazla olduğunda yüksek tansiyonunuz var. Kan basıncınızı düşüren ilaçlar, inme veya kalp krizi geçirme olasılığınızı azaltır.
Yüksek tansiyon, kalbin vücuda kan pompalamak için daha fazla çalışmasını sağlar ve kan damarlarına zarar verir. MICARDIS HCT tabletleri kan damarlarınızın gevşemesine yardımcı olabilir, böylece kan basıncınız düşer.
Blister nasıl açılır:
- Gözyaşı (Ayrıca blisteri parçalara ayırmak için makas da kullanabilirsiniz)
- Soyma (Alüminyum folyodan kağıt katmanını soyun)
- İtin (Tableti folyonun içinden itin)
 |
 |
Bu Hasta Bilgileri ABD Gıda ve İlaç Dairesi tarafından onaylanmıştır.
Bu çalışmaya 1 / Mayıs / 2002 ve 31 / Ağustos / 2005 tarihleri arasında Fırat Üniversitesi Tıp Fakültesi HT polikliniğinde hafif orta şiddette esansiyel hipertansiyon saptanan 100 hasta (yaş ortalaması 50.18±9.9 50'si erkek; 50'si kadın) alındı. Hastalar ile ilgili genel demografik bilgiler tablo 1 de verilmiştir. Çalışma Helsinki bildirgesine uygun bir biçimde yapıldı.
Çalışmaya Alınma Kriterleri:
1. Sekonder HT nedenlerinin dışlanmış olması,
2. On sekiz yaşından sonra veya 50 yaşından önce HT tanısının konmuş hastalar,
3. Yeni HT tanısı alan veya antihipertansif tedavi almayan hastalar,
4. JNC VII' ye göre evre 1 (sistolik kan basıncı 140– 159 mmHg arasında olanlar veya diyastolik kan basıncı 90–99 mmHg arasında olanlar) veya evre 2 (sistolik kan basıncı 160 mmHg üzeri olanlar veya diyastolik kan basıncı 100 mmHg olanlar) HT olan hastalar,
5. Çalışmaya katılmayı kabul etmiş olan hastalar.
Çalışma dışı tutulma kriterleri:
1. Şiddetli veya malin HT tanısı konulmuş hastalar,
2. Diyabetes mellitus, metabolik sendrom öyküsü olan veya insülin metabolizması üzerine etkili ilaç kullanan hastalar,
3. Tuz diyetine uymayan hastalar,
4. Bilinen koroner arter hastalığı, kalp yetmezliği, aritmi, kapak hastalığı, kronik obstrüktif akciğer hastalığı, pulmoner hipertansiyonu, nörolojik hastalığı, renal disfonksiyonu, gebeliği, aşırı obez (vücut kitle indeksi 35'in üzerinde), ekokardiyografide teknik açıdan yeterli görüntü elde edilemeyen, beta-bloker ve ARB kullanımı için kontrendikasyonu olan hastalar çalışma dışı bırakılmıştır.
Çalışmaya alınan hastaların öyküleri alınıp fizik muayeneleri yapıldı. Boy ve kiloları ölçülerek vücut kitle indeksleri ve vücut yüzey alanları hesaplandı. Tüm hastalara 3 hafta süre ile günde 6 gr'dan az NaCl içeren tuzdan fakir diyet, haftada en az 4 gün 30 dakikayı aşan düz yol egzersizi, alkol kısıtlı (maksimum 20 gr/gün) ve sebze ve meyve ağırlıklı DASH diyeti uygulandı. Üç haftanın sonunda 24 saatlik idrarda Na+ ve K+ ıtrahına bakılarak diyete uyumu kontrol edildi. Tuz diyetine ve diğer yaşam modifikasyonuna uymayan hastalar çalışmadan çıkartıldı. Çalışmaya alınan hastalardan 12 saatlik açlık periyodundan sonra sabah kan glükozu, serum üre, kreatinin, elektrolitler, total kolesterol, trigliserid, LDL kolesterol, HDL kolesterol ve insülin seviyeleri ölçüldü. Her hastanın ilk başvurduğu anda elektrokardiyografisi, ekokardiyografisi çekildi, kan basıncı cıvalı manometre ile oturur pozisyonda ve koldan kalp seviyesinde ölçüldü ve kaydedildi.
Hipertansiyon tanısı en az 3 haftadır yukarda bahsedilen yaşam modifikasyonuna uyan hastalarda, sabah ve öğleden sonra saatlerinde olmak kaydıyla en az üç ardışık gün ölçümünde, kan basıncının 140/90 mmHg'nın üzerinde bulunması ile konuldu.
Kan Basıncının Ölçülmesi: İlk muayenedeki ölçümler her iki koldan yapıldı, yüksek olan koldaki kan basıncı hastanın kan basıncı olarak kabul edildi. İzlemelerdeki kan basıncı ölçümleri tercihen sağ koldan yapıldı. Ölçümler arası en az ikişer dakika olan üç ölçüm yapıldı. Bulunan sonuçların ortalaması hastanın kan basıncı olarak kabul edildi. Kan basıncı ölçümleri sabah 09 ve öğleden sonra 16 da olmak üzere iki defa yapıldı. Kan basıncı ölçümleri 30 dakika öncesinden sigara, çay veya kahve içmemiş, kafein almamış, yemek yememiş ve egzersiz yapmamış haliyle yapıldı. Fenilefrinli nazal dekonjestanlar veya benzeri adrenerjik uyarıcıların kullanmıyor olması dikkate alındı. Hasta sessiz bir odada en az 5 dakika istirahat ettikten sonra oturur pozisyonda KB ölçümüne başlandı. Erka marka cıvalı tansiyon ölçme cihazı ile ölçümler alındı. Ortalama kan basıncı= Diyastolik Kan Basıncı + (Sistolik Kan Basıncı- Diyastolik Kan Basıncı) / 3 formülü ile hesaplandı. Hastaların tedaviye başlanmadan önceki, tedavinin 1. ayındaki, 3. ayındaki ve 6. aynıdaki sistolik kan basıncı, diyastolik kan basıncı ve ortalama kan basıncı değerleri kaydedildi. Kan basıncı Ölçümleri hep aynı kişi tarafından yapıldı.
Glükoz ve lipid metabolizması değerlendirilmesi: Tüm hastalardan 3 haftalık yukarda bahsedilen yaşam modifikasyonu uygulandıktan sonra plazma örnekleri alındı. Plazma örnekleri, 12 saatlik açlık periyodu sonrası, anjiyoket yardımı ile sol antekubital venden alınarak laboratuara gönderildi. Kan örneklerinden, Olympus marka test kitleri ile Olympus AU 2700 Otoanalizör (Olympus Optimal Co Ltd- Japon) cihazı kullanılarak serum glükoz, üre, kreatinin, total kolesterol, trigliserid, LDL kolesterol, VLDL kolesterol, HDL kolesterol ve elektrolit düzeyleri ölçümleri yapıldı. Aynı örneklerden serum insülin düzeyleri Immblıte-2000 Hormon Analizatörü (Losangales. USA.) ile Immblıte-2000 kiti kullanılarak kemiluimmunesans yöntemi ile tayin edildi.
İnsülin rezistansı: HOMA formülünden [HOMA 12 = Açlık insülin (µÜ/mlt)xAçlık kan şekeri (mmol/lt)/22.5] hesaplandı 8.
Elektrokardiyografi: Tüm vakalara Nihon Kohden marka Elektrokardiyografi (EKG) cihazı ile rutin 12 kanallı standart EKG kaydı alındı ve EKG'de sol ventrikül hipertrofisi kriterlerini gösteren Romhilt-Estes puan sistemine göre değerlendirildi 9.
Ekokardiyografi: Hastaların tamamına kardiyoloji kliniğinde aynı kardiyolog tarafından Acuson Sequa 512 marka, 3.2mHz yetişkin probe ile hastalara sol yan supin pozisyonunda transtorasik ekokardiyografi yapıldı. Parasternal uzun aks, kısa aks, apikal dört boşluk ve iki boşluk görüntüleri alınarak M-mode, B mode ve pulse wave doppler yöntemi ile sol ventrikül sistolik ve diyastolik fonksiyonları değerlendirildi. Arka duvar kalınlığı, interventriküler septum kalınlığı, sol ventrikül sistol sonu çapı ve sol ventrikül diyastol sonu çapı, E/A oranları ve izovolumetrik gevşeme zamanı (IVRT) deselerasyon zamanı (DT) ölçüldü. Amerikan Ekokardiyografi Cemiyetinin önerdiği şekilde, sol ventrikül kitlesi ve kitle indeksi Devereux metoduna göre hesaplandı 10.
Buna göre;
SVK=1.04((İVSK+SVDSÇ+ADK)3-SVDSÇ3: )-13.6 (gr)
SVKI=SVK/ vücut yüzey alanı (gr/m2)
Sol ventrikül kitlesi vücut yüzey alanına bölünerek “sol ventrikül kitle indeksi” hesaplandı. Sol ventrikül kitle indeksinin üst sınırı erkeklerde 134g/m2, kadınlarda 110g/m2 olarak kabul edildi 11. Bu rakamların üzerine sahip kişilerde “sol ventrikül hipertrofisi” tanısı kondu.
Sol ventrikül diyastolik fonksiyonları: Pulsed-wave doppler ile transmitral akım velositesinden pik erken diyastolik akım (Evel), pik geç diyastolik akım (Avel) hızları, deseleresyon zamanı (DT) ve izovolümetrik relaksasyon zamanı (IVRT) ölçümleri yapıldı; E/A oranı hesaplandı. Evel
MICARDIS 80 mg 28 tablet
MICARDIS® 80 mg Tablet
Ağız yoluyla alınır.
- Etkin madde: Telmisartan.
Her bir MICARDIS 80 miligram Tablet, 80 miligram telmisartan içerir. - Yardımcı maddeler: Povidon (K25), meglumin, sodyum hidroksit, sorbitol (E420), magnezyum stearat.
| ATC | Kamu No | Eşdeğer Kodu | Türü | Birim Miktar | Ambalaj | Üretim Yeri | Ruhsat Tar. | Ruhsat No |
|---|---|---|---|---|---|---|---|---|
| C09CA07 | A05003 | E244A | Orjinal İlaç | 80 MG | 28 | ithal | 2000-07-03 | 108/12 |
| Dünya Sağlık Örgütü(DSÖ) | ||
|---|---|---|
| Temel İlaç | Çocuk Temel İlaç | Yenidoğan Temel İlaç |
| DSÖ listesinde bulunmayan ilaç | DSÖ listesinde bulunmayan ilaç | DSÖ listesinde bulunmayan ilaç |
MICARDIS 80 mg 28 Tablet Nedir ve Ne için kullanılır?
MICARDIS tablet formunda üretilmektedir. Tabletler beyaz renkli, çentikli ve uzun olup, bir yüzünde şirket logosu, diğer yüzünde 52 H ifadesi bulunur.
MICARDIS, 28 tablet içeren blister ambalajlarda piyasaya sunulmaktadır.
MICARDIS “anjiyotensin II reseptör antagonisti” olarak adlandırılan ilaç grubuna dahildir. Anjiyotensin II, vücudunuz tarafından üretilir ve kan damarlarının daralmasına, böylece kan basıncının yükselmesine neden olur. Telmisartan, anjiyotensin II maddesinin bu etkisini engeller, böylece kan damarları genişler ve kan basıncı düşer.
MICARDIS, esansiyel hipertansiyonun (yüksek kan basıncının) tedavisi için kullanılır. “Esansiyel” ifadesi, yüksek kan basıncının başka bir nedenle ortaya çıkmadığını gösterir.
Yüksek kan basıncı, tedavi edilmediği takdirde, çeşitli organlardaki kan damarlarında harabiyete yol açabilir. Böylelikle, bazı durumlarda kalp krizleri, kalp veya böbrek yetmezliği, felç veya körlük ile sonuçlanabilir. Yüksek kan basıncı genellikle, bu tür bir harabiyet ortaya çıkmadan önce belirti vermez. Bu nedenle, tansiyonunuzu düzenli olarak ölçtürüp normal sınırlar içinde olup olmadığını kontrol etmeniz çok önemlidir.
MICARDIS aynı zamanda, aşağıdaki durumlar nedeniyle risk altında bulunan erişkinlerde kalp-damar sistemiyle ilgili olayların (örn. kalp krizi ya da inme) önlenmesi için de kullanılmaktadır:
- Kalbe ya da bacaklara giden kan miktarının azalması veya bloke olması,
- İnme geçirmiş olma,
- Organ hasarı bulunan şeker (diyabet) hastalığı.
Doktorunuz bu gibi olaylar yönüyle yüksek risk altında olup olmadığınızı size söyleyecektir.
MICARDIS 80 mg 28 Tablet Kullanmadan önce dikkat edilmesi gerekenler
Kullanılmaması gereken durumlar
Eğer;
- Telmisartana veya yukarıda “yardımcı maddeler” bölümünde belirtilen MICARDIS içindeki yardımcı maddelerden herhangi birine karşı alerjik (aşırı duyarlı) iseniz;
- Hamileliğin 3. ayını tamamladıysanız (erken gebelik dönemlerinde de MICARDIS kullanımından kaçınmanız önerilir. Bkz. “Hamilelik”),
- Kolestaz veya biliyer obstrüksiyon (safranın karaciğerden ve safra kesesinden boşalması ile ilgili sorunlar) gibi ağır karaciğer sorunlarınız veya diğer şiddetli karaciğer hastalığınız varsa
Yukarıdaki durumlardan herhangi biri sizin için geçerli ise, MICARDIS almadan önce doktorunuza veya eczacınıza danışınız.
Dikkatli kullanılması gereken durumlar
Eğer;
- Böbrek hastalığınız varsa veya size böbrek nakli yapıldıysa
- Böbreklerinizden birinin veya her ikisinin kan damarlarında darlık bulunuyorsa
- Karaciğer hastalığınız varsa
- Kalbinizde sorun varsa
- Aldosteron düzeyleriniz yüksek ise (kandaki çeşitli minerallerin dengesizliği ile birlikte vücutta su ve tuz tutulması)
- Tansiyonunuz düşükse (vücudunuzun aşırı su kaybına veya idrar söktürürcü tedavi nedeniyle tuz kaybına, düşük tuzlu diyete, ishale veya kusmaya bağlı olabilir)
- Kanınızda potasyum düzeyleri yükselmiş ise
- Şeker hastası iseniz.
Gebe olduğunuzu veya gebe olma ihtimaliniz olduğunu düşünüyorsanız, mutlaka doktorunuzu bilgilendiriniz. MICARDIS, erken gebelik döneminde önerilmez. 3 aylıktan daha büyük gebeliklerde ise kullanılmamalıdır. Bu ilaç eğer gebeliğin 3. ayından sonra kullanırsa, bebeğe ciddi şekilde zarar verebilir (bkz. “Hamilelik”).
Ameliyat veya anestezi gereken durumlarda doktorunuza MICARDIS kullandığınızı söyleyiniz.
MICARDIS kan basıncını düşürmede, siyah ırkta diğer ırklara göre daha az etkilidir. Çocuklar ve ergenler:
MICARDIS kullanımı, çocuklarda ve 18 yaşından küçük ergenlerde önerilmez.
Bu uyarılar, geçmişteki herhangi bir dönemde dahi olsa, sizin için geçerliyse lütfen doktorunuza danışınız.
Araç ve makine kullanımı
MICARDIS kullanan bazı kişilerde zaman zaman baş dönmesi ve yorgunluk ortaya çıkabilir. Baş dönmesi ve yorgunluk hissediyorsanız, araç veya makine kullanmayınız.
MICARDIS’in içeriğinde bulunan bazı yardımcı maddeler hakkında önemli bilgiler
- MICARDIS sorbitol içermektedir. Eğer daha önceden doktorunuz tarafından bazı şekerlere karşı tahammülsüzlüğünüz (intolerans) olduğu söylenmişse, bu tıbbi ürünü kullanmadan önce doktorunuzla temasa geçiniz.
Diğer ilaçlar ile birlikte kullanımı
Herhangi bir başka ilaç kullanıyorsanız veya son zamanlarda kullandınız ise veyahut başka bir ilaç alma ihtimaliniz varsa, doktorunuzu bilgilendiriniz. Doktorunuz, kullandığınız ilaçların dozunu değiştirebilir veya başka önlemler alabilir. Bazı durumlarda ilaçlardan birini bırakmak zorunda kalabilirsiniz. Özellikle aşağıda listelenen ilaçlar MICARDIS ile birlikte, aynı zamanda kullanılacaksa bu durum geçerlidir:
- Lityum içeren ilaçlar (bazı depresyon tiplerinin tedavisi için kullanılır)
- Kan potasyum düzeyinizi yükseltebilen ilaçlar: potasyum tutan idrar söktürücüler, potasyum destekleri, potasyum içeren tuz destekleri, ACE inhibitörleri, anjiyotensin II reseptör antagonistleri, steroid olmayan iltihap giderici ilaçlar (örneğin: aspirin veya ibuprofen), heparin, immün sistemi baskılayıcı ilaçlar (örneğin: siklosporin veya takrolimus) ve enfeksiyonlara karşı kullanılan bir ilaç olan trimetoprim gibi tıbbi ürünler.
- İdrar söktürücü ilaçlar: Özellikle MICARDIS ile birlikte yüksek dozlarda kullanıldıklarında, vücuttaki suyun aşırı derecede kaybına ve böylece tansiyonunuzun düşmesine neden olurlar.
MICARDIS diğer yüksek tansiyon ilaçlarının kan basıncını düşürücü etkilerini artırabilir.
MICARDIS ile birlikte steroid olmayan antiinflamatuar grubu ilaçlar (aspirin ve ibuprofen gibi ağrı kesici ve iltihap giderici etkisi olan ilaçlar) ya da kortikosteroid türü ilaçlar kullandığınızda, MICARDIS’in kan basıncını düşürücü etkisi azalabilir.
Eğer reçeteli ya da reçetesiz herhangi bir ilacı şu anda kullanıyorsanız veya son zamanlarda kullandınız ise, lütfen doktorunuza veya eczacınıza bunlar hakkında bilgi veriniz.
Yiyecek içecek etkileşimleri
(Aç/Tok/Alkol kullanım durumları)
MICARDIS aç karına ya da yiyeceklerle birlikte alınabilir.
MICARDIS 80 mg 28 Tablet Nasıl Kullanılır?
Doğru ilaç kullanımı nasıl olmalı?
Tabletler bir miktar su ile birlikte yutulmalıdır. MICARDIS’i aç karnına veya yemeklerle birlikte alabilirsiniz. İlacınızı her gün, günün aynı saatinde almaya özen gösteriniz.
MICARDIS’i her zaman için tam olarak doktorunuzun söylediği şekilde alınız. Eğer emin değilseniz, doktorunuza ya da eczacınıza sormalısınız.
MICARDIS’in günde bir kez bir tablet şeklinde kullanılması önerilmektedir. Tableti mümkün olduğunca günün aynı saatinde almaya dikkat ediniz.
Doktorunuz başka türlü söylemedikçe, MICARDIS’i her gün almaya devam etmeniz çok önemlidir. MICARDIS’in etkisinin çok güçlü veya çok zayıf olduğunu düşünüyorsanız, doktorunuz veya eczacınız ile konuşunuz.
Yüksek tansiyon tedavisi:
Yüksek tansiyonu 24 saat süreyle kontrol altında tutabilmek için normal MICARDIS dozu, hastaların çoğunda günde bir kez 40 mg'dır. Ancak doktorunuz bazen daha düşük bir dozu (20 mg) veya daha yüksek bir dozu (80 mg) almanızı tavsiye edebilir.
Karaciğer sorununuz varsa, günde 40 mg’dan fazla kullanmayınız.
Telmisartan, alternatif olarak, telmisartan ile birlikte kullanıldığında kan basıncında ilave bir düşürücü etki yaptığı gösterilen hidroklorotiyazid ile kombine olarak da kullanılabilir.
Kalp-damar sistemiyle ilgili olayların önlenmesi:
Önerilen doz günde bir kez 80 mg’lık bir tablettir.
80 mg telmisartandan daha düşük dozların kalp-damar hastalıklarına bağlı olayların önlenmesinde etkili olup olmadığı bilinmemektedir.
MICARDIS ® 80 mg ile koruyucu tedavinin başlarında, kan basıncı sık aralıklar ile izlenmelidir. Gerekirse diğer kan basıncı düşürücü ilaç dozlarının ayarlanması önerilir.
Çocuklar ve Bebeklerde Kullanımı
MICARDIS kullanımı, çocuklarda ve 18 yaşından küçük ergenlerde önerilmez.
Yaşlılarda Kullanımı
MICARDIS yaşlı kişilerde doz ayarlaması yapmadan kullanılabilir.
Özel Kullanım Durumları
Böbrek yetmezliği:
Hafif-orta derecede böbrek yetmezliği olan hastalarda doz ayarlamasına gerek yoktur. Şiddetli böbrek yetmezliği olanlarda ve hemodiyalize giren hastalarda başlangıç olarak daha düşük doz önerilir.
Karaciğer yetmezliği:
Hafif veya orta derecede karaciğer yetmezliği olan hastalarda günlük doz 40 mg'ı geçmemelidir. Şiddetli karaciğer hastalığı olanlarda kullanılmamalıdır.
Eğer MICARDIS’in etkisinin çok güçlü veya zayıf olduğuna dair bir izleniminiz var ise doktorunuz veya eczacınız ile konuşunuz.
Doz Aşımı ve Tedavisi
MICARDIS’ten kullanmanız gerekenden fazlasını kullanmışsanız, bir doktor veya eczacı ile konuşunuz.
Eğer kazaen daha fazla tablet alırsanız, gecikmeden doktorunuza ne yapacağınızı sorunuz veya en yakın hastanenin acil servisine müracaat ediniz.
Kullanmayı Unutursanız:
Eğer ilacınızı almayı unutursanız, bu dozu aynı gün içerisinde hatırlar hatırlamaz alınız. Eğer tabletinizi aynı gün almaz iseniz, bir sonraki gün normal dozunuzu alınız. Aynı gün içerisinde iki doz almayınız.
Unutulan dozları dengelemek için çift doz almayınız.
MICARDIS ile tedavi sonlandırıldığında oluşabilecek etkiler
- MICARDIS ® kullanmayı bıraktığınızda kan basıncınız, ani yükselmeler olmaksızın, birkaç gün içerisinde basamaklı olarak tedavi öncesi düzeylerine dönecektir.
- Bu ilacın kullanımıyla ilgili başka sorularınız olursa, doktorunuza sorunuz.
Hamilelik döneminde kullanılır mı?
İlacı kullanmadan önce doktorunuza veya eczacınıza danışınız.
Eğer gebe olduğunuzu veya gebe olma ihtimaliniz olduğunu düşünüyorsanız, mutlaka doktorunuzu bilgilendiriniz. Doktorunuz, normal olarak, hamile kalmanızdan önce veya hamile olduğunuzu öğrenir öğrenmez ilacınızı kesecek ve size MICARDIS’ten başka bir ilaç önerecektir. MICARDIS, erken gebelik döneminde önerilmez. 3 aylıktan büyük gebeliklerde ise kesinlikle kullanılmamalıdır. Çünkü gebeliğin 3. ayından sonra kullanılması halinde bebekte ciddi zararlar oluşturabilir.
Tedaviniz sırasında hamile olduğunuzu fark ederseniz, hemen doktorunuza veya eczacınıza danışınız.
Gebelik döneminde ilaç kullanımı hakkında
Gebelik döneminde ilaç konusunda sıkça sorulan sorular
Emzirme döneminde kullanır mı?
İlacı kullanmadan önce doktorunuza veya eczacınıza danışınız.
Emziriyorsanız veya emzirmeye başlamak üzereyseniz doktorunuzu bilgilendiriniz. MICARDIS, emziren kadınlarda önerilmez. Eğer emzirmek istiyorsanız, özellikle bebeğiniz yeni doğan veya prematüre (erken doğum) ise, doktorunuz sizin için başka bir ilaç önerecektir
Yan Etkileri
Tüm ilaçlar gibi, MICARDIS’in içeriğinde bulunan maddelere duyarlı olan kişilerde yan etkiler olabilir.
Aşağıdakilerden biri olursa MICARDIS kullanmayı durdurunuz ve DERHAL doktorunuza bildiriniz veya size en yakın hastanenin acil bölümüne başvurunuz:
Sepsis*: (“kan zehirlenmesi” olarak da adlandırılan, bütün vücutta enflamasyon (iltihap) şeklinde ortaya çıkan şiddetli bir enfeksiyon durumu), cilt ve mukozada ani şişme (anjiyoödem).
Bunların hepsi çok ciddi yan etkilerdir ve oldukça seyrek (1000 kullanıcıdan 1’ine kadar sıklıkta) görülür. Bu durumda ilacı kullanmayı derhal kesiniz ve derhal doktorunuza başvurunuz. Bu etkiler tedavi edilmez ise ölümle sonuçlanabilir.
MICARDIS’in olası yan etkileri:
Yaygın yan etkiler (10 kullanıcıdan 1 kişiye kadarını etkiler):
Kan basıncında düşme (kardiyovasküler olay azaltma için kullanan kastalarda)
Yaygın olmayan yan etkiler (100 kullanıcıdan 1kişiye kadarını etkiler):
İdrar yolu enfeksiyonları, üst solunum yolu enfeksiyonları (örneğin: boğaz ağrısı, sinüslerde iltihap, soğuk algınlığı), alyuvarlarda azalma (anemi), potasyum düzeyinde yükselme, uykuya dalmada güçlük, depresyon, bayılma, baş dönmesi, kalp atımının yavaşlaması, düşük tansiyon, ayağa kalkarken baş dönmesi (ortostatik hipotansiyon), nefes darlığı, öksürük, karın ağrısı, ishal, karın bölgesinde rahatsızlık hissi, şişkinlik, kusma, kaşıntı, terlemede artma, ilaç döküntüsü, sırt ağrısı, kasta kramplar, kas ağrısı, akut böbrek yetmezliği dahil böbrek işlevlerinde bozulma, göğüste ağrı, halsizlik hissi ve kanda kreatinin (vücutta üretilen bir maddeden oluşan ve böbrek işlevlerini değerlendirmek için laboratuar testlerinde aranan bir madde) düzeyinde artma.
Seyrek yan etkiler (1000 kullanıcıdan 1 kişiye kadarını etkiler):
Çok seyrek yan etkiler (10.000 kullanıcıdan 1 kişiye kadarını etkiler):
Akciğer dokusunda ilerleyen nedbeleşme (bağ dokusu oluşumu) (interstisyel akciğer hastalığı)**
*Bu olay şans eseri olarak ortaya çıkmış olabilir veya henüz bilinmeyen bir mekanizmaya bağlı olarak görülebilir.
** Telmisartan kullanımı sırasında akciğer dokusunda ilerleyen nedbeleşme (bağ dokusu oluşumu) vakaları bildirilmiştir. Bununla birlikte, nedenin telmisartan olup olmadığı bilinmemektedir.
Herhangi bir yan etki ile karşılaşırsanız, doktorunuza veya eczacınıza bildiriniz.
Eğer bu kullanma talimatında bahsi geçmeyen herhangi bir yan etki ile karşılaşırsanız, doktorunuzu veya eczacınızı bilgilendiriniz
Saklanması
MICARDIS’i çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız.
25 oC’nin altındaki oda sıcaklığında, nemden koruyarak saklayınız.
Son kullanma tarihiyle uyumlu olarak kullanınız.
Ambalajdaki son kullanma tarihinden sonra MICARDIS’i kullanmayınız.
Son kullanma tarihi, ayın son gününü gösterir.
Eğer üründe ve/veya ambalajında bozukluklar fark ederseniz MICARDIS’i kullanmayınız.
Çevreyi korumak amacıyla kullanmadığınız MICARDIS’i şehir suyuna veya çöpe atmayınız. Bu konuda eczacınıza danışınız.
Ruhsat Sahibi
Boehringer Ingelheim İlaç Ticaret A.Ş. Büyükdere Cad. USO Center
No: 245, K: 13-14
34398 Maslak - İSTANBUL
Tel: (0 212) 329 1100 Faks: (0 212) 329 1101
Üretici
Boehringer Ingelheim Pharma GmbH & Co. KG Binger Strasse 173
D-55216, Ingelheim am Rhein Almanya
Bu kullanma talimatı tarihinde onaylanmıştır.
MICARDIS İlaçları
Micardis Plus
Farmakoterapötik grup: anjiyotensin II antagonistleri ve diüretikleri, ATC kodu: C09DA07
Micardis Plus, bir anjiyotensin II reseptör antagonisti, telmisartan ve bir tiazid diüretik, hidroklorotiyazidin bir kombinasyonudur. Bu bileşenlerin kombinasyonu, ilave bir hipotansif etkiye sahiptir ve kan basıncını tek başına herhangi bir bileşenden daha fazla düşürür. Micardis Plus günde bir kez terapötik doz aralığında kan basıncında etkili ve pürüzsüz bir düşüşe neden olur.
Etki mekanizması
Telmisartan oral olarak aktif ve spesifik bir anjiyotensin II reseptör alt tipi 1'dir (AN1) - Antagonistler. Telmisartan, anjiyotensin II'yi at üzerindeki bağlanma yerinden çok yüksek bir afinite ile yer değiştirir1 - anjiyotensin II'nin bilinen etkilerinden sorumlu reseptör alt tipi. Telmisartan, at'de kısmi agonist aktivite göstermez1 - reseptör. Telmisartan DEN'i seçici olarak bağlar1 - reseptör. Bağlama dayanıklıdır. Telmisartan, AT dahil diğer reseptörlere yakınlık göstermez2 ve daha az karakterize edilmiş diğer reseptörler. Bu reseptörlerin fonksiyonel rolü bilinmemektedir ve seviyeleri telmisartan ile arttırılan anjiyotensin II ile olası aşırı uyarılmanızın etkisi bilinmemektedir. Plazma baldosteron seviyeleri telmisartan ile azalır. Telmisartan insan plazma reninini inhibe etmez veya iyon kanallarını engellemez. Telmisartan, bradikinin'i de parçalayan enzim olan anjiyotensin dönüştürücü enzimi (kininaz II) inhibe etmez. Bu nedenle, bradikinin aracılı yan etkilerin güçlendirilmesi beklenmemektedir.
Sağlıklı gönüllülere uygulanan 80 mg'lık bir telmisartan dozu, kan basıncında uyandırılan anjiyotensin II artışını neredeyse tamamen inhibe eder. İnhibitör etki 24 saat boyunca korunur ve yine de 48 saate kadar ölçülebilir.
Hidroklorotiyazid bir tiazid diüretiktir. Tiazid diüretiklerinin kan basıncını düşürücü etkisinin mekanizması tam olarak bilinmemektedir. Tiyazidler elektrolit emiliminin renal tübüler mekanizmalarını etkiler ve sodyum ve klorür atılımını yaklaşık eşdeğer miktarlarda doğrudan arttırır. Hidroklorotiyazidin diüretik etkileri plazma hacmini azaltır, plazma renin aktivitesini arttırır, aldosteron sekresyonunu arttırır, bu da idrarda potasyum ve bikarbonat kaybında bir artışa ve serum potasyumunda bir azalmaya yol açar. Muhtemelen renin-anjiyotensin-aldosteron sistemini bloke ederek, telmisartanın birlikte uygulanması, bu diüretiklerle ilişkili potasyum kaybını tersine çevirme eğilimindedir. Hidroklorotiyazid ile diürez 2 saat içinde başlar ve pik etki yaklaşık 4 saat sonra ortaya çıkar, etki yaklaşık 6-12 saat sürer.
Klinik etkililik ve güvenlik
Esansiyel hipertansiyon tedavisi
İlk telmisartan dozundan sonra, antihipertansif aktivite 3 saat içinde yavaş yavaş ortaya çıkar. Kan basıncındaki maksimum düşüşe genellikle tedavinin başlamasından 4-8 hafta sonra ulaşılır ve uzun süreli tedavi sırasında korunur. Antihipertansif etki, dozlamadan 24 saat sonra sabit kalır ve ayaktan kan basıncı ölçümlerinin gösterdiği gibi, bir sonraki dozdan önceki son 4 saati içerir. Bu, plasebo kontrollü klinik çalışmalarda 40 ve 80 mg telmisartan dozlarından sonra% 80'in üzerinde maksimum etki noktasında ve bir sonraki dozdan (zirve koşullarına kadar) hemen önce alınan ölçümlerle doğrulanır.
Hipertansiyonu olan hastalarda telmisartan, nabız hızını etkilemeden hem sistolik hem de diyastolik kan basıncını azaltır. Telmisartanın kan basıncını düşürücü etkinliği, diğer antihipertansif ilaç sınıflarındaki aktif maddelerinkiyle karşılaştırılabilir (telmisartanın amlodipin, atenolol, enalapril, hidroklorotiyazid ve lisinopril ile karşılaştırıldığı klinik çalışmalarda kanıtlanmıştır).
Çift kör kontrollü bir klinik çalışmada (n = 687 hasta, etkinlik açısından test edilmiş olan) 80 mg / 12.5 mg kombinasyonuna yanıt vermeyenlerde, 80 mg / 12.5 mg 2.7 / 1.6 mm Hg kombinasyonu ile devam eden tedaviye kıyasla 80 mg / 25 mg kombinasyonunun artımlı kan basıncını düşürücü etkisi (SBP / DBP) kanıtlanmış (Düzeltilmiş ortalama değişimlerdeki fark, başlangıç değerine göre değişir). 80 mg / 25 mg kombinasyonu ile yapılan bir takip çalışmasında, kan basıncı daha da düşürüldü (bu da toplam 11.5 / 9.9 mm Hg (SBP / DBP) azalmaya yol açtı).
Valsartan / hidroklorotiyazid 160 mg / 25 mg'a kıyasla benzer 8 haftalık çift kör plasebo kontrollü klinik çalışmaların birleştirilmiş analizinde (n = 2121 hasta, etkinlik açısından test edilmiş olan) 2.2 / 1.2 mm Hg'lik önemli ölçüde daha yüksek kan basıncını düşürücü bir etkiydi (SBP / DBP) kanıtlanmış (Düzeltilmiş ortalama değişimlerdeki fark, başlangıç değerine göre değişir) telmisartan / hidroklorotiyazid kombinasyonu lehine 80 mg / 25 mg.
Telmisartan ile tedavinin aniden sona ermesinden sonra, kan basıncı, herhangi bir geri tepme hipertansiyonu belirtisi olmadan birkaç günlük bir süre boyunca yavaş yavaş tedavi öncesi seviyelere döner.
Kuru öksürük insidansı, telmisartan ile tedavi edilen hastalarda, iki hipotansif tedavinin doğrudan karşılaştırıldığı klinik çalışmalarda anjiyotensin dönüştürücü enzim inhibitörleri verilen hastalara göre anlamlı derecede düşüktü.
Kardiyovasküler önleme
UNUTMAYIN (Devam Eden Telmisartan Yalnız ve Ramipril Global Endpoint Denemesi ile Birlikte) telmisartanın etkilerini karşılaştırdı, ramipril ve telmisartan ve ramipril'in kardiyovasküler üzerinde kombinasyonu, koroner arter hastalığı öyküsü olan 55 yaş ve üstü 25620 hasta ile sonuçlanır, İnme, TIA, periferik arter hastalığı veya tip 2 diabetes mellitus, son organ hasarı kanıtı eşliğinde (Örneğin. Retinopati, sol ventrikül hipertrofisi, makro veya mikro albüminüri) kardiyovasküler olaylar için risk altındaki tek popülasyon.
Hastalar aşağıdaki üç tedavi grubundan birine randomize edildi: telmisartan 80 mg (n = 8542), ramipril 10 mg (n = 8576) veya telmisartan 80 mg artı ramipril 10 mg (n = 8502) kombinasyonu ve ortalama gözlem süresi 4.5 yıldır.
Telmisartan, kardiyovasküler ölümün birincil bileşik uç noktasını, ölümcül olmayan miyokard enfarktüsünü, ölümcül olmayan inmeyi veya konjestif kalp yetmezliği için hastaneye yatmayı azaltmada ramipril ile benzer bir etkiye sahipti. Birincil sonlanım noktasının insidansı telmisartan (% 16.7) ve ramipril (% 16.5) gruplarında benzerdi. Telmisartan için risk oranı. ramipril sahtekarlığı 1.01 (% 97.5 CI 0.93 - 1.10, p (aşağılık olmaması) = 1.13 marjla 0.0019). Toplam ölüm oranı% 11.6 veya idi. Telmisartan ve ramipril ile tedavi edilen hastalarda% 11.8.
Bulundu, telmisartanın kardiyovasküler ölümün önceden tanımlanmış ikincil son noktasında olduğunu, ölümcül olmayan miyokard enfarktüsü ve ölümcül olmayan inme benzer şekilde etkili ramiprildir [0.99 (% 97.5 CI 0.90-1.08) s (aşağılık değil) = 0.0004] UMUT referans çalışmasındaki birincil son nokta (Kalp Çıktılarını Önleme Değerlendirme Çalışması) ramiprilin plaseboya göre etkilerini incelemişti.
TRANSCEND randomize ACE - I-INTOLERANTE, standart bakıma ek olarak ONTARGET'ten telmisartan 80 mg (n = 2954) veya plasebo (n = 2972) ile benzer dahil etme kriterlerine sahip hastalar. Dolandırıcılığın ortalama takip süresi 4 yıl 8 aydır. Birincil kompozit sonlanım noktasının insidansında istatistiksel olarak anlamlı bir fark yoktu (kardiyovasküler ölüm, ölümcül olmayan miyokard enfarktüsü, konjestif kalp yetmezliği için ölümcül olmayan inme veya hastaneye yatış) tespit [0.92 risk oranı ile telmisartanda% 15.7 ve plasebo gruplarında% 17.0 (% 95) 0.81 - 1.05, p = 0,.22). Kardiyovasküler ölüm, ölümcül olmayan miyokard enfarktüsü ve ölümcül olmayan inmenin önceden tanımlanmış ikincil bileşik uç noktasında plaseboya kıyasla telmisartan kullanıldığına dair kanıtlar vardı [0.87 (% 95) 0.76 - 1.00, p = 0.048)]. Kardiyovasküler mortalite için kullanım kanıtı yoktu (tehlike oranı 1.03,% 95 CI 0.85 - 1.24).
Telmisartan ile tedavi edilen hastalarda ramipril ile tedavi edilen hastalara göre öksürük ve anjiyoödem daha az bildirilirken, telmisartan ile hipotansiyon daha sık bildirilmiştir.
Telmisartanın ramipril ile kombinasyonu, sadece ramipril veya telmisartandan daha fazla avantaj sağlamamıştır. CV mortalitesi ve tüm nedensellik kombinasyonla sayısal olarak daha yüksekti. Düşük kombinasyonda hiperkalemi, böbrek yetmezliği, hipotansiyon ve senkop insidansı da anlamlı derecede yüksekti. Bu nedenle, bu popülasyonda telmisartan ve ramipril kombinasyonunun kullanılması önerilmez.
"İkinci Vuruşlardan Etkili Bir Şekilde Kaçınılması İçin Önleme Rejimi" çalışmasında (PROFESS) 50 yaş ve üstü hastalarda, son zamanlarda felç geçirdi, telmisartanın plasebo ile karşılaştırıldığında% 0.49'a kıyasla artmış sepsis insidansı bulundu [RR 1.43 (% 95 güven aralığı 1.00 - 2.06) ölümcül sepsis vakalarının insidansı hastalarda idi, telmisartan geliri, arttı (% 0.33) hastalara doğru, plasebo geliri (% 0.16) [RR 2.07 (% 95 güven aralığı 1.14-3.76). Telmisartan kullanımı ile bağlantılı olarak gözlenen artmış sepsis oranı ya rastgele bir bulgu olabilir ya da şu anda bilinmeyen bir mekanizma ile ilişkili olabilir.
İki büyük randomize, kontrollü çalışma (ONTARGET (Yalnız devam eden Telmisartan ve Ramipril Global Endpoint Denemesi ile birlikte) ve VA NEPHRON-D (diyabet için nefropati gazileri)) incelenen bir anjiyotensin II Reseptör bloker ile ACE inhibitörünün kombinasyonunu kullanmıştır. .
ONTARGET, kardiyovasküler veya serebrovasküler hastalık veya tip 2 diabetes mellitus öyküsü olan hastalarda, endorgan hasarı belirtileri ile ilişkili bir çalışmadır. Daha ayrıntılı bilgi için yukarıdaki “Kardiyovasküler önleme” başlığına bakın. VA NEPHRON-D, tip 2 diyabetes mellitus ve diyabetik nefropatisi olan hastalarda yapılan bir çalışmadır. Bu çalışmalar böbrek ve / veya kardiyovasküler sonuçlar ve mortalite üzerinde anlamlı bir olumlu etki göstermezken, monoterapiye kıyasla hiperkalemi, akut böbrek yaralanmaları ve / veya hipotansiyon riski artmıştır. Benzer farmakodinamik özellikleri nedeniyle, bu sonuçlar diğer ACE inhibitörleri ve anjiyotensin II reseptör blokerleri için de geçerlidir. Bu nedenle ACE inhibitörleri ve anjiyotensin II reseptör blokerleri diyabetik nefropatili hastalarda aynı anda kullanılmamalıdır.
ALTITUDE (kardiyovasküler ve böbrek hastalıkları için uç noktaları kullanarak tip 2 diyabette aliskiren çalışması) tip 2 diyabetes mellitus ve kronik böbrek hastalığı olan hastalarda ACE inhibitörü veya anjiyotensin II reseptör bloker ile standart tedaviye aliskiren ilavesinden yararlanan bir çalışmadır, kardiyovasküler her ikisi de. Olumsuz sonuç riskinin artması nedeniyle çalışma erken sonlandırıldı. Aliskiren grubunda kardiyovasküler ölüm ve inme plasebo grubuna göre daha yaygındı ve advers olaylar ve ciddi advers olaylar (hiperkalemi, hipotansiyon ve böbrek yetmezliği) aliskiren grubunda plasebo grubuna göre daha sık bildirildi.
Epidemiyolojik çalışmalar, hidroklorotiyazid ile uzun süreli tedavinin kardiyovasküler mortalite ve morbidite riskini azalttığını göstermiştir.
Telmisartan / HCTZ'nin katı doz kombinasyonunun mortalite ve kardiyovasküler morbidite üzerindeki etkileri şu anda bilinmemektedir.
Pediatrik popülasyon
Micardis 80 mg 28 Tablet
Kalp Damar Sistemi - Kan Basıncını Düzenleyen İlaçlar - Anjiyotensin II Antagonistleri - Anjiyotensin II Antagonistleri - Telmisartan
| İlaç Adı: | Micardis 80 mg 28 Tablet |
|---|---|
| Firma: | Boehringer Ingelheim İlaç |
| Etkin Madde: | Telmisartan |
| ATC Kodu: | C09CA07 |
| Kamu Kodu: | A05003 |
| Barkod: | 8699693010087 |
| Fiyatı: | 107,27 TL |
| Reçete Tipi: | Normal Reçete |
| e-Reçete: | Aktif |
| Temin: | İlacınızı sadece eczaneden alınız! |
Micardis 80 mg 28 Tablet Endikasyonları
Micardis; nedeni tam olarak bilinmeyen yüksek tansiyonun (esansiyel hipertansiyon) tedavisinde kullanılmaktadır.
Micardis 80 mg Fiyatı
Micardis 80 mg 28 Tablet, ilaç fiyatı: Türkiye Cumhuriyeti Sağlık Bakanlığı'na bağlı İEGM (TİTCK) tarafından 23.04.2023 tarihi itibariyle açıklanan KDV dahil satış fiyatı 107,27 TL dir. Boehringer Ingelheim İlaç firması tarafından satışa sunulan 8699693010087 barkod numaralı bu ilaç Orijinal/Jenerik/Yirmi Yıllık sınıflandırmasında Orijinal ilaç sınıfındadır.
Micardis 80 mg 28 Tablet Etkin Maddesi
Micardis 80 mg ilacının etkin maddesi olan Telmisartan, orjinal ismiyle Telmisartan maddesinin Milli Tıp Kütüphanesi kayıt numarası (CAS No) 144701-48-4 olup, molekül ağırlığı 514.6169 g/mol, formülü ise C33H30N4O2 dir. Telmisartan maddesinin hamilelik / gebelik kategorisi D'dir, bu etkin madde bulunan ilaçlar ağız yoluyla alınır.
Micardis 80 mg ilacının ana etkin maddesi Telmisartan için Kimyasal Yapı Resmi:
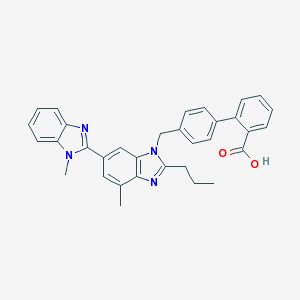
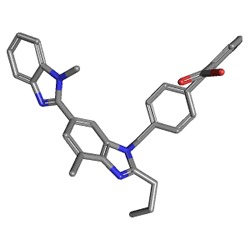
Micardis 80 mg 28 Tablet ilacının Kategorisi
Kalp Damar Sistemi - Kan Basıncını Düzenleyen İlaçlar - Anjiyotensin II Antagonistleri - Anjiyotensin II Antagonistleri - Telmisartan
Micardis 80 mg 28 Tablet Uyarılar
ilaç tr uyarısı: Hiçbir ilacı doktorunuza ya da eczacınıza danışmadan kullanmayınız. Unutmayınız ki, internet sitelerinde ilaçlar hakkında verilen bilgiler, bir uzmanın sizi muayene ederek vereceği reçetenin yerini tutmaz. Bu sayfada Micardis 80 mg kullananlar veya diğer kişiler ilaç hakkında yorum yapamaz.
MICARDIS 80 mg 28 tablet Yan Etkileri
4.Olası yan etkiler nelerdir ?
Tüm ilaçlar gibi MICARDIS’in içeriğinde bulunan maddelere duyarlı olan kişilerde yan etkiler olabilir.
Aşağıdakilerden biri olursa MICARDIS kullanmayı durdurunuz ve DERHAL doktorunuza bildiriniz veya size en yakın hastanenin acil bölümüne başvurunuz:
- Yüz, ağız ve boğazda şişme (anjiyoödem), kurdeşen ve bunlara eşlik edebilecek nefes darlığı ile birlikte olabilen şiddetli alerjik, anaflaktik reaksiyonlar;
Bunların hepsi çok ciddi yan etkilerdir.
Eğer bunlardan sizde mevcut ise, sizin MICARDIS'e karşı ciddi alerjiniz var demektir. Acil tıbbi müdahaleye veya hastaneye yatırılmanıza gerek olabilir. Bu çok ciddi yan etkilerin hepsi oldukça seyrek görülür.
Aşağıdakilerden herhangi birini fark ederseniz, hemen doktorunuza bildiriniz veya size en yakın hastanenin acil bölümüne başvurunuz:
- Gece idrara kalkma, halsizlik, nefes darlığı, çarpıntı, idrar miktarında azalma, el, ayaklar ve göz etrafında şişme (akut böbrek yetmezliği belirtileri olabilir);
- Bayılmalar;
- Yapılan tahlillerde kanda potasyum seviyelerinin yüksek bulunması;
- Deride ilaç döküntüsü ve toksik deri döküntüsü.
Bunların hepsi ciddi yan etkilerdir. Acil tıbbi müdahale gerekebilir. Ciddi yan etkiler çok seyrek görülür.
Aşağıdakilerden herhangi birini fark ederseniz, doktorunuza söyleyiniz:
MICARDIS ile ayrıca aşağıdaki istenmeyen etkiler ile de karşılaşılmıştır:
"Yaygın olmayan" sıklık derecesindeki istenmeyen etkiler (100 kişide 1'den az, 1,000 kişide 1'den fazla):
- Uykusuzluk,
- İç kulak ve merkez sinir sistemi kaynaklı baş dönmesi,
- Düşük kan basıncı,
- Nefes darlığı,
- Karın ağrısı, ishal, hazımsızlık, mide ve bağırsaklarda gaz,
- Fazla terleme, kaşıntı, deri döküntüsü,
- Kas spazmları (bacaklarda kramp), kas ağrısı,
- Böbrek bozukluğu,
- Göğüs ağrısı, halsizlik
"Seyrek" sıklık derecesindeki istenmeyen etkiler (1,000 kişide 1'den az, 10,000 kişide 1'den fazla):
- Üst solunum yolu infeksiyonları,
- Kansızlık (anemi), kan pulcuklarında azalma,
- Aşırıduyarlılık,
- Korku ve endişe hali, çökmüş ruh hali,
- Görme bozukluğu,
- Nabızda hızlanma,
- Yatar durumda veya otururken ayağa kalkıldığında kan basıncının düşmesi,
- Ağız kuruluğu, midede huzursuzluk hissi, kusma,
- Karaciğer fonksiyonlarında anormallik, karaciğer bozukluğu,
- Deride kızarma,
- Eklem ağrısı, sırt ağrısı, bacaklarda ağrı,
- Grip hastalığına benzer hastalık,
- Kanda ürik asit, kreatinin, karaciğer enzimleri ve kreatin fosfokinaz artışları.
"Bilinmiyor" sıklık derecesindeki istenmeyen etkiler (eldeki verilerden hareketle sıklık tahmin edilemiyor):
- Mesane infeksiyonu dahil idrar yolu infeksiyonları,
- Allerjik reaksiyon,
- Kanda "eozinofil" adı verilen akyuvar türünde artış,
- Nabızda yavaşlama,
- Egzama,
- Tendon ağrısı (tendon iltihabına benzer belirtiler / tendonlar kasların kemik ile birleşmelerini sağlayan özel yapılardır),
- Hemoglobinde azalma (kanda oksijen taşıyan molekül).
Bunlar MICARDIS'in hafif yan etkileridir.
Yan etkilerin raporlanması
Kullanma Talimatında yer alan veya almayan herhangi bir yan etki meydana gelmesi durumunda hekiminiz, eczacınız veya hemşireniz ile konuşunuz. Ayrıca karşılaştığınız yan etkileri www.titck.gov.tr sitesinde yer alan “İlaç Yan Etki Bildirimi“ ikonuna tıklayarak ya da 0 800 314 00 08 numaralı yan etki bildirim hattını arayarak Türkiye Farmakovijilans Merkezi (TÜFAM)‘ne bildiriniz. Meydana gelen yan etkileri bildirerek kullanmakta olduğunuz ilacın güvenliliği hakkında daha fazla bilgi edilnilmesine katkı sağlamış olacaksınız.
 Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır.
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar.
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar.Micardis Plus 80 mg / 12.5 mg
Micardis Plus 80 mg / 12.5 mg tablet formunda üretilmektedir. Tabletler beyaz renkli, çentikli ve uzun olup, bir yüzünde şirket logosu, diğer yüzünde 52 H ifadesi bulunur. MICARDIS, 28 tablet içeren blister ambalajlarda piyasaya sunulmaktadır. MICARDIS “anjiyotensin II reseptör antagonisti” olarak adlandırılan ilaç grubuna dahildir. Anjiyotensin II, vücudunuz tarafından üretilir ve kan damarlarının daralmasına, böylece kan basıncının yükselmesine neden olur. Telmisartan, anjiyotensin II maddesinin bu etkisini engeller, böylece kan damarları genişler ve kan basıncı düşer. MICARDIS, esansiyel hipertansiyonun (yüksek kan basıncının) tedavisi için kullanılır. “Esansiyel” ifadesi, yüksek kan basıncının başka bir nedenle ortaya çıkmadığını gösterir. Yüksek kan basıncı, tedavi edilmediği takdirde, çeşitli organlardaki kan damarlarında harabiyete yol açabilir. Böylelikle, bazı durumlarda kalp krizleri, kalp veya böbrek yetmezliği, felç veya körlük ile sonuçlanabilir. Yüksek kan basıncı genellikle, bu tür bir harabiyet ortaya çıkmadan önce belirti vermez. Bu nedenle, tansiyonunuzu düzenli olarak ölçtürüp normal sınırlar içinde olup olmadığını kontrol etmeniz çok önemlidir
Micardis Plus 80 mg / 12.5 mg Fiyatı öğrenmek için bizimle iletişime geçebilirsiniz:
Detaylı bilgi için iletişime geçinÖnemli Uyarı: Sitemizde ilaç satışı, ilaç temini veya ilaç promosyonu gibi bir faaliyetimiz yoktur. Ayrıca sitemiz üzerinde tıbbi konularda yardım veya danışma hizmeti de verilmemektedir. Sitede yer alan tüm bilgiler hasta ve doktorların ilaçlar hakkında bilgi sahibi olması için hazırlanmıştır. Sitemizdeki bilgilerin eksik veya güncellenmemiş olmasından sitemiz yasal sorumluluk altında değildir. Siteye giren kullanıcılarımız bu koşulları kabul etmiş sayılır. İlaç kullanmadan önce, lütfen doktorunuza danışınız.
- Micardis Plus 80 mg / 12.5 mg Fiyatı
- Micardis Plus 80 mg / 12.5 mg Yan Etkileri
- Micardis Plus 80 mg / 12.5 mg Nasıl Kullanılır?
- Micardis Plus 80 mg / 12.5 mg Sipariş
Hemen İletişime Geçin
Ürünlerimiz ve hizmetlerimiz hakkında bilgi almak, aklınıza takılan soruların cevaplarını almak için bizimle hemen iletişime geçebilirsiniz.
Hemen İletişime GeçinPera Ecza Deposu @2020. Tüm Hakları Saklıdır.
gelişim planı örnekleri 2022 doğum borçlanmasi ne kadar uzaktaki birini kendine aşık etme duası 2021 hac son dakika allahümme salli allahümme barik duası caycuma hava durumu elle kuyu açma burgusu dinimizde sünnet düğünü nasil olmali başak ikizler aşk uyumu yht öğrenci bilet fiyatları antalya inşaat mühendisliği puanları malta adası haritada nerede